Shrinidh Joshi, consultor medtech on Kolabtree, provides 3 tips for successful dispositivo médico desenvolvimento que ajudará a levar seu produto ao mercado rapidamente.
When you have an idea (either on a back of a ‘napkin’ or still brainstorming) for the development of a new medical device, it is very much likely that your idea will be disruptive like ‘no other’ and it will have a significant impact on the saúde or it is just another way to look at the things. There is also a possibility that your product will help to resolve some of the current challenges for example ‘form factor’ and bulkiness of the spirometer device was a huge challenge until the discovery of portable, hand-held spirometer devices. Similarly, the discovery of blood glucose monitors was transformative like no other for millions of diabetics.
Não é necessário projetar um dispositivo médico que seja extraordinário ou perturbador, um dispositivo médico que possa agregar valor aos usuários existentes também tem as chances de oferecer benefícios ao usuário, como software como um dispositivo médico como o BlueStar. [1] que ajuda no estilo de vida e no gerenciamento de medicamentos para diabéticos. O maior dilema para a inicialização de um dispositivo médico é se seu dispositivo será capaz de capturar uma participação lucrativa no mercado. Na maioria das vezes, o dilema decorre ou do controle de qualidade ou da validade do dispositivo médico ou da complexidade de trazer um dispositivo médico para o mercado. Para os dispositivos médicos iniciantes, eu diria que sem ter especialistas para guiá-lo durante todo o processo, ambos podem levar ao descarrilamento de seu projeto. Em alguns casos, se você projetou um dispositivo médico que possui o potencial de perturbar o mercado e trazer novas maneiras de ver o tratamento, talvez você não tenha pensado nas exigências regulatórias que esse tipo de dispositivo pode ter, ou talvez as agências reguladoras não sejam capazes de classificar seu dispositivo. Fiz uma parceria com uma empresa que teve a brilhante idéia de combinar um dispositivo terapêutico com um dispositivo de diagnóstico para proporcionar benefícios de ponta a ponta ao usuário final, entretanto, a confusão para a agência reguladora foi rever esse dispositivo como um medicamento ou abaixo de 510(k) como um dispositivo de diagnóstico. Portanto, uma abordagem holística considerando todos os aspectos da validade do projeto, controle de qualidade e estrutura regulatória é uma abordagem mais sábia em vez de enfrentá-los como e quando necessário. Ela requer precisão em cada etapa - desde a ideação do produto até o projeto e desenvolvimento, conformidade, testes, aumento de escala e comercialização do produto.
Neste artigo, vamos dar uma olhada na fase de projeto e desenvolvimento do processo de desenvolvimento de dispositivos médicos. Esta etapa, como se pode pensar, é a fase mais importante no ciclo de vida de um dispositivo médico. Como uma inicialização de um dispositivo médico, se você deixar de fora qualquer etapa chave na definição ou projeto de seu dispositivo médico, você pode arriscar a não conformidade com as agências reguladoras e seu dispositivo não será capaz de chegar ao mercado. Mesmo que você seja bem sucedido em contornar os obstáculos regulatórios para um dispositivo definido ou projetado de forma frouxa, ele pode eventualmente falhar em entregar suas reivindicações sobre o uso pretendido ou benefícios sobre seus antecessores ou concorrentes. Por outro lado, um produto bem definido e projetado tem muito potencial para suas reivindicações sobre interrupção do mercado e eventual adoção no mercado.
Como todo produto de saúde, seja um medicamento ou um dispositivo médico, é necessário um esforço considerável e meticuloso para oferecer a solução certa que possa atender às exigências de um cliente. Como uma inicialização de um dispositivo médico, é necessário garantir que todas as partes interessadas estejam alinhadas com o escopo do produto, os resultados, a definição, a especificação, o projeto e o fator forma, a estratégia de mitigação de risco e os requisitos regulamentares. Essencialmente, todos os esforços acima devem ser direcionados para a melhor qualidade possível para seu dispositivo médico.
Desenvolvimento de Dispositivos Médicos: Da Fase de Produto à Fase de Descoberta
1. Ideação e Conceptualização de Produtos
The first step in medical device innovation is to analyze and identify the medical device market. As mentioned above, you are analyzing to see if your device is meeting unmet medical needs like early diagnosis of a difficult to cure disease or it is providing a more efficient way to manage a chronic disease. The problem statement for your medical device could be a novel or a better way to monitor adherence to the treatment regimen, monitoring ailment and health, improving drug delivery minimizing the drug requirements and adverse drug events, using inteligência artificial, aprendizagem de máquinas, aprendizagem profunda, or real-world insights etc. Innovative software can also be defined and approved as a medical device under a software as a medical device (SaMD) category.
Identificar a necessidade com a demanda é um passo primordial para criar uma oferta de dispositivo médico, além de estar pronto para a conformidade. O sucesso disto depende muito de duas coisas:
- A lacuna entre a necessidade do mercado alvo e o que o desenvolvedor de dispositivos médicos percebe como a necessidade; quanto menor a lacuna, melhores serão os insumos para a definição do produto;
- Uma forte definição do produto é extraída através da análise das necessidades do mercado.
O processo geral de desenvolvimento de dispositivos médicos pode ser simplificado conforme a figura 1 mostrada abaixo.
Como uma inicialização de um dispositivo médico, é importante apoiar sua inovação científica e de engenharia com agilidade para se mover mais rápido horizontalmente através do processo de decisão regulatória e isto poderia ser alcançado tendo pontos de verificação estratégicos em cada etapa do processo de desenvolvimento do dispositivo médico. Pense nisso do ponto de vista do ciclo de vida do produto, você estará sempre enfrentando desafios, desde o início da idéia até o lançamento no mercado e desde a aprovação regulatória até a adoção pelo mercado. O ponto é os desafios e o desenvolvimento de dispositivos médicos são enrolados juntos e a única maneira de desbobiná-los é através do impulso científico/engenharia no lado do desenvolvimento e através de decisões regulatórias baseadas na ciência no lado da aprovação.
2. Classificação do dispositivo
Após a ideação do produto e as características definidas, o próximo passo é verificar a classificação regulatória baseada no risco de seu dispositivo. Você precisa ter certeza de identificar o risco associado ao seu dispositivo e selecionar a classe apropriada com base no mercado regulatório que você escolher entrar. Nesta etapa, você também pode precisar garantir que o uso pretendido de seu dispositivo esteja claramente definido. Isto é muito importante e se você estiver planejando para o 510(k), certifique-se de que o uso pretendido de seu dispositivo corresponda com o dispositivo predestinado.
Dependendo da localização geográfica e regulamentar que você pretende aplicar para seu dispositivo médico, seja nos EUA ou na Comissão Européia, você pode precisar classificar seu dispositivo de acordo com o painel de classificação de dispositivos médicos (Classificação de dispositivos médicos do FDA dos EUA) ou MEDDEV 2.4/1 Rev. 9 (PT orientação MEDDEV), respectivamente. De longe, o maior componente de sua apresentação será coberto pela seção de classificação de produtos médicos. Esta seção define os requisitos regulamentares para seu dispositivo. Dependendo da classe do dispositivo médico que você selecionou, é uma boa idéia verificar os documentos de orientação existentes publicados pelas autoridades reguladoras. Por exemplo, nos EUA, metade do tempo pode ser possível que a FDA já tenha um documento de orientação relevante à sua aplicação. Tal orientação pode servir como uma referência pronta para o ciclo acelerado de revisão e melhores chances de aprovação em seu primeiro arquivamento. Estes documentos de orientação são publicados para orientar tanto empresas inovadoras de produtos médicos como a sua quanto os revisores da agência para uma revisão mais rápida dos pedidos. Além disso, você precisa procurar qualquer Propriedade Intelectual pré-existente sobre a idéia proposta ou similar; pode não permitir que você use o mecanismo ou a tecnologia. Para realizar uma fase de descoberta completa, uma equipe de desenvolvimento forte é crucial. Isto pode ser uma armadilha se a equipe não for bem experiente. Em qualquer caso, você pode decidir ir com uma equipe interna, um consultor, ou uma empresa de engenharia de dispositivos médicos.
A consideração chave para as empresas enquanto procuram um consultor interno ou externo consultor de dispositivos médicos é que eles devem ter experiência nas seguintes áreas:
- Engenharia e projeto
- Fatores humanos e engenharia de usabilidade
- Conhecimento clínico e científico da indústria médica
- Regulatory affairs and quality assurance
- Direito de propriedade intelectual
3. Fase de Descoberta
The discovery phase where you will take your idea into the initial designing stage and develop prototypes for your device. This stage involves a lot of brainstorming with engineers, design consultants and your team to make 3D prototypes through simulations and computer-assisted designs and test those prototypes for proof-of-concept. You should also start looking at the FDA guidance documents to find out which critical functionality tests are pertinent to your device and start using them as a decision-matrix for finalizing the ideal design of your device. For the startups which are still boot-strapping for finances, it will be cost-prohibitive to run all the tests as per the guidance documents so I would rather advise to choose one or two most relevant tests and use them for design optimization. Once you have optimized your medical device concept and design, you may now proceed for regulatory approval and commercialization. It is noteworthy here that the US FDA critical path initiative focused on the science of development: better toxicology, biomarcadores, improved ensaios clínicose medicina personalizada, mas essa iniciativa, como outras, incluindo as iniciativas de reengenharia dos anos 90 e as mudanças legislativas que acompanharam as taxas de uso dos dispositivos, não examinou a estrutura regulatória do próprio processo de aprovação e como a estrutura regulatória determina as escolhas na ciência do desenvolvimento.
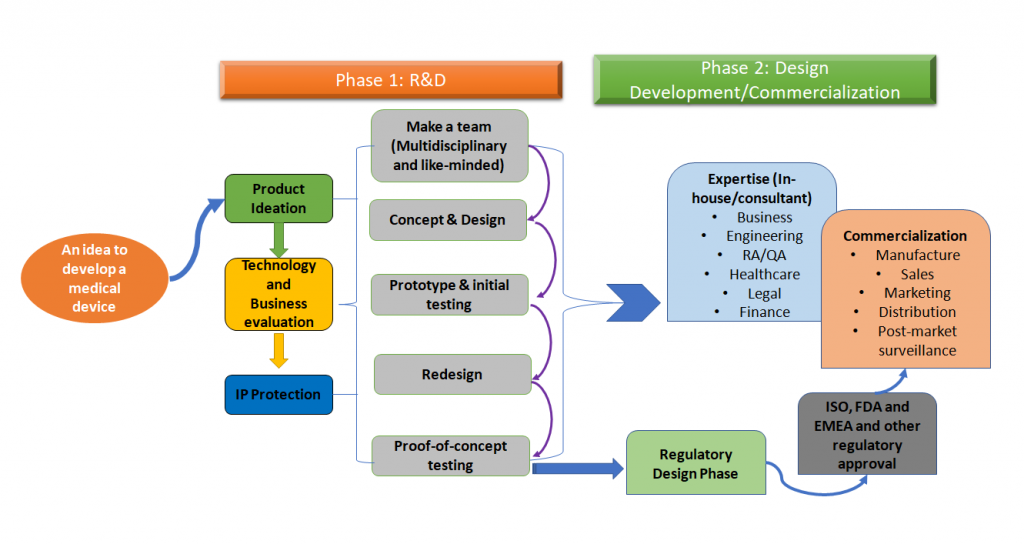
Figura 1: O desenvolvimento de dispositivos médicos é um processo holístico. Esta é uma versão simplificada do processo que é uma abordagem por fases, mas idealmente, todas as etapas de todo este processo precisam ser mapeadas antecipadamente durante o desenvolvimento do dispositivo médico (Adaptado de [1,2]).
Precisa de ajuda para desenvolver um dispositivo médico? Navegue consultores em dispositivos médicos em Kolabtree. É livre para contatar um especialista ou postar seu projeto.
Leia também: Quanto custa contratar um consultor de produtos médicos?
Referências
- https://www.welldoc.com/health-plans/
- https://ec.europa.eu/docsroom/documents/10337/attachments/1/translations
- FDA, 2005, Total Product Lifecycle, FDA-CDRH Apresentação pelo Diretor do CDRH Dr. David Feigal, http://www.fda.gov/cdrh/strategic/presentations/ tplc.html
Todos os artigos desta série:
Desenvolvimento e Projeto de Dispositivos Médicos: Um Guia Definitivo
Desenvolvimento de Dispositivos Médicos: 3 Dicas para o Sucesso
Projeto de dispositivos médicos: O Essencial, Guia Passo a Passo
Comercialização de Produtos médicos: 9 Passos do Esboço ao Lançamento
Como superar os desafios da comercialização de dispositivos médicos
Lançamento de Dispositivos Médicos: Passos chave para trazer seu produto ao mercado
Vigilância pós-mercado de produtos médicos: Um Guia Abrangente







