Kolabtree freelance biostatistician consultant, Rudra Patel provides a comprehensive guide on how to develop a Statistical Analysis Plan (SAP) for Ensaios clínicos.
1. Plano de Análise Estatística (SAP) em um Estudo Clínico (CT)
Um Plano de Análise Estatística (SAP) bem redigido e completo é importante para aumentar a qualidade dos ensaios clínicos e torná-lo mais válido e generalizado.
SAP is a defined outline of the planned statistical basic/advance methods for the analyses for a clinical trial and is written in study protocol as well as separately. SAP is crucial and is one of the key Regulatory confidential documents in the development of a clinical trial. An SAP is a more challenging task in a clinical trial protocol development that requires a strong command on statistical methodology, medical terminology and visualization power. It provides explicit guidance on statistical programming and the presentation of results for clinical trial. The following four important types of SAP are used in a clinical trial (Figure 1).
- Monitoramento de dados
- Análise estatística interina
- Plano integrado de análise estatística
- Plano de análise estatística para estudo clínico
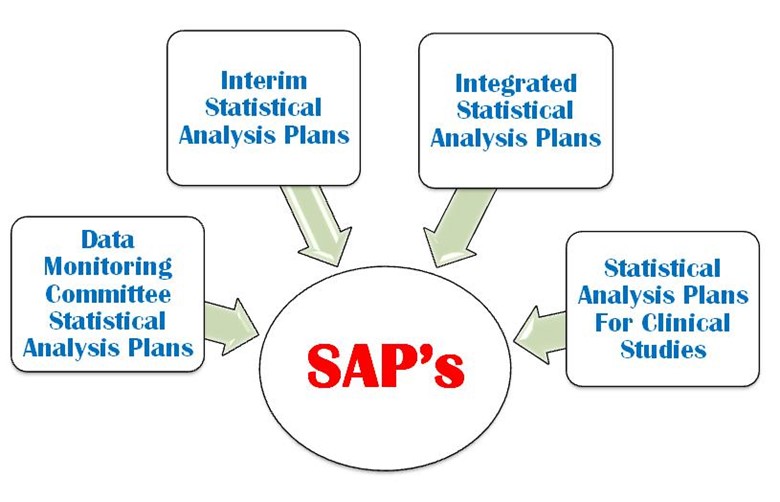
Figura 1: Quatro tipos importantes de SAP são utilizados em um CT
The SAP is mostly written as a separate document or it is included in CT study protocol as a standard operating procedure for dealing with the statistical part of the clinical study. A team estatístico médico/biostatistician is in-charge of developing the SAP in coordination with the principal investigator of the CT study. The document should be reviewed by Senior Biostatistician and finalized before to submission to the review board and regulatory authorities. If any protocol amendments are done, then the SAP is amended as well.
The SAP must properly explain following the aims and primary objectives, secondary objective, exploratory objectives, primary/secondary/exploratory endpoints, trial population, design of the trial, sample size calculations with justifications/assumptions, and the randomization methods. Additionally, an SAP must describe in detail the statistical methodology i.e. efficacy analysis, safety análise de dados, reporting conventions, etc. Figure 2 shows the most important points that need to be considering when developing SAP in the clinical trial study protocol.
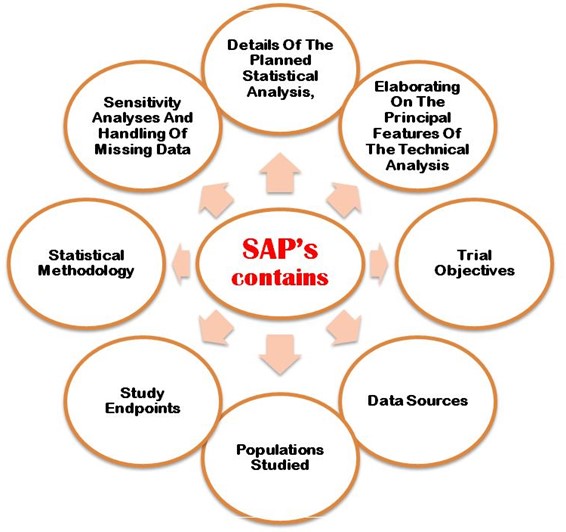
Figura 2: Pontos importantes detalhados considerados ao desenvolver o SAP no protocolo CT.
O plano de análise desenvolvido deve ser revisto com atenção especial e aprovado pelo bioestatístico sênior cego antes do bloqueio do banco de dados pelas autoridades. Ahrweiler et al. 2011 documento de conferência publicado on-line explicou a importância do plano de análise estatística de revisão. Os seguintes pontos importantes detalhados foram considerados ao desenvolver o SAP no protocolo CT,
- Detalhamento da análise estatística planejada
- Elaborando sobre as principais características da análise técnica.
- Objetivos do estudo
- Fontes de dados
- População estudada
- Pontos finais do estudo
- Metodologia estatística
- Análise de sensibilidade e dados ausentes
O estudo clínico SAP deve estar sendo desenvolvido com uma discussão aprofundada entre os principais pesquisadores e estatístico. A seguir, o papel e a responsabilidade dos estaticistas,
- Para escrever um pesquisa statement or hypothesis of the clinical trial study.
- Determinar os pontos finais primários e secundários.
- Descobrir e desenvolver uma estratégia para reduzir o viés e a seleção do tamanho da amostra para ensaios clínicos
- Para definir todos os métodos estatísticos apropriados para análise de dados de ensaios clínicos
No desenvolvimento do SAP no ensaio clínico, é necessário explicar em profundidade os pontos-chave de destaque. Yuan et al.2019 publicaram um artigo de interesse especial sobre "Guia para o plano de análise estatística” [Figura 2]. O artigo fornece em profundidade o SAP de um estudo real de pesquisa de ensaios clínicos é para fornecer um guia prático detalhado sobre como escrever um SAP eficaz. Além disso, no mesmo artigo discutimos onde, por que de um SAP, quando e quem, e destacamos o conteúdo chave do SAP. A necessidade de um estudo de pesquisa de ensaios clínicos para SAPs bem escritos e documentados, particularmente para estudos regulatórios.
2. Importância do Plano de Análise Estatística em Ensaios Clínicos
O TC é conduzido em todos os processos de desenvolvimento de novos medicamentos/medicamentos e dispositivos médicos. Desde a última década, o aumento da taxa de pacientes recrutados em ensaios clínicos para o desenvolvimento de medicamentos/medicamentos tem sido proveniente da Europa e dos EUA, bem como de países em desenvolvimento.
Em estudos clínicos, o SAP é um dos documentos de importância crítica. Ele garante que as análises para avaliar todas as hipóteses de estudo pré-planejadas sejam realizadas de forma cientificamente válida e que todas as decisões sejam documentadas. Ele também fornece detalhes detalhados sobre como os resultados serão apresentados e relatados no CT.
Clinical trials are used to assess the additional benefits and improve interventions in medical cuidados com a saúde. The more important thing to consider while conducting a clinical trial is to execute the trial with minimum bias. Therefore, each clinical trial to have a clear and detailed SAP to its support to reproducibility. For the best practice of CT scientific research studies, reproducibility of research, and to avoid concerns of misuse of clinical research, a clear detailed and very transparent SAP much be needed, to improve trial conduct and reporting. Following are three essential roles of SAP needs to maintain in conducting CT.
- Transparência: Transparência sobre como a análise irá proceder, especificando antecipadamente a metodologia que será aplicada
- Comunicação: Comunicação clara a todos os envolvidos no estudo sobre como proceder
- Replicação: Facilita a replicação para que uma equipe de pesquisa futura possa seguir os mesmos passos para confirmar os resultados na mesma amostra ou em uma nova amostra.
De acordo com as diretrizes padrão com melhores práticas, é importante que o estatístico/biostatatístico do projeto de ensaio clínico prepare um estudo SAP antes do início do ensaio clínico, detalhando todas as análises planejadas, parâmetros de estudo, incluindo definições do conjunto de análises e metodologia estatística básica/avançada.
Além disso, algumas outras considerações importantes relacionadas ao SAP no CT incluem:
- Uma maneira de minimizar o preconceito é cegar o bioestatístico.
- O SAP deve ser documentado de tal forma que todas as manipulações e análises de dados realizadas possam ser replicadas.
- É necessário que o bioestatístico mantenha um arquivo mestre de ensaio com toda a documentação relevante na conclusão do ensaio.
O plano de análise organizado sistematicamente ajuda a equipe de ensaios clínicos a estar junta na mesma página e acrescenta outra camada de especificidade ao TC. Ele descreve a metodologia estatística sistemática planejada de um estudo de pesquisa de um ensaio clínico. Em comparação com o protocolo de ensaio clínico, o SAP é um documento técnico aprofundado no qual técnicas estatísticas detalhadas para o desenho e análise de dados de ensaios clínicos. Enquanto escrevemos o SAP, geralmente seguimos as diretrizes da ICH E3 e E9. Isto nos dá uma idéia do conteúdo corporal de seções individuais do SAP. Mas o E3 e o E9 não especificam técnicas estatísticas específicas.
Para melhorar a reprodutibilidade, transparência e validade entre os ensaios clínicos. Os Institutos Nacionais de Saúde (NIH) publicou "Rules for clinical trials studies registration and results information submission" (Regras para o registro de estudos clínicos e envio de informações sobre os resultados), na qual mandata o registro do estudo, a publicação do recrutamento ou resultados de estudos clínicos em andamento dentro do ClinicalTrials.gov , e o envio do plano de análise estatística (SAP) do documento original separado, juntamente com o protocolo do estudo de pesquisa do estudo clínico.
A grande contribuição do estatístico médico/biostatatístico além de desenvolver um SAP padrão é a concepção, monitoramento e análise dos dados dos ensaios clínicos.
3. Lista de verificação/orientações detalhadas para SAPs em ensaios clínicos
Ao desenvolver o SAP do CT, precisamos levar em consideração todas as listas de verificação/orientações padronizadas detalhadas. As diretrizes importantes utilizadas no desenvolvimento do SAP são ICH E9 (International Conference for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use) e SPIRIT (Standard Protocol Items: Recommendations for Interventional Trials).
Transparência e reprodutibilidade têm sido um termo fundamental para agregar valor aos dados dos ensaios clínicos. Entretanto, a influência da metodologia estatística afeta diretamente na tomada de decisões de ensaios clínicos, bem documentada, mantida a confidencialidade e a conduta estatística transparente é essencial. O especialista em estatística médica/biostatatístico pode ajudar a desenvolver SAPs de acordo com as diretrizes padrão.
De acordo com a ICH E9 SAP normalmente conhecida como planos de relatório e análise também pode ser conhecida como Planos de Análise de Dados (DAP) ou Planos de Análise Estatística (SAP) em outras organizações. As diretrizes da ICH E9 estabelecem que "as principais características do eventual SAP dos dados devem ser descritas na seção estatística do protocolo". Entretanto, as diretrizes do SPIRIT (Standard Protocol Items: Recommendations for Interventional Trials) referem-se a um SAP separado.
O SAP é um documento essencial em CT que precisa de relatório para as autoridades reguladoras (por exemplo, Food and Drug Administration (FDA), Agência Européia de Medicamentos (EMA)). As diretrizes padrão sugerem que a SAP precisa ser armazenada no arquivo mestre de ensaios clínicos confidencialmente e é utilizada durante as auditorias regulamentares para verificar se os documentos estatísticos são seguidos exatamente pelas diretrizes padrão.
O SAP é o documento mais comumente utilizado para orientar os estaticistas. Em geral, os seguintes documentos devem ser incluídos em um SAP (Figura 3).
O estaticista deve ser encaminhado para O Declaração do CONSORT (e quaisquer extensões) e também ICH E9 Princípios Estatísticos para Ensaios Clínicos (PDF, 325 KB).
- Estação de planejamento e projeto de ensaios
- A Rede EQUATOR- Um centro de recursos para uma boa elaboração de relatórios de estudos de pesquisa em saúde.
- O site do CONSORT
- Em 2017, as diretrizes publicadas por Gamble et al..2017, as diretrizes destes artigos recomendam um mínimo de 55 itens importantes que devem ser considerados ao desenvolver um SAP seguinte.
- Título e registro
- Introdução
- Métodos de estudo
- Princípios estatísticos
- População de teste
- Análise
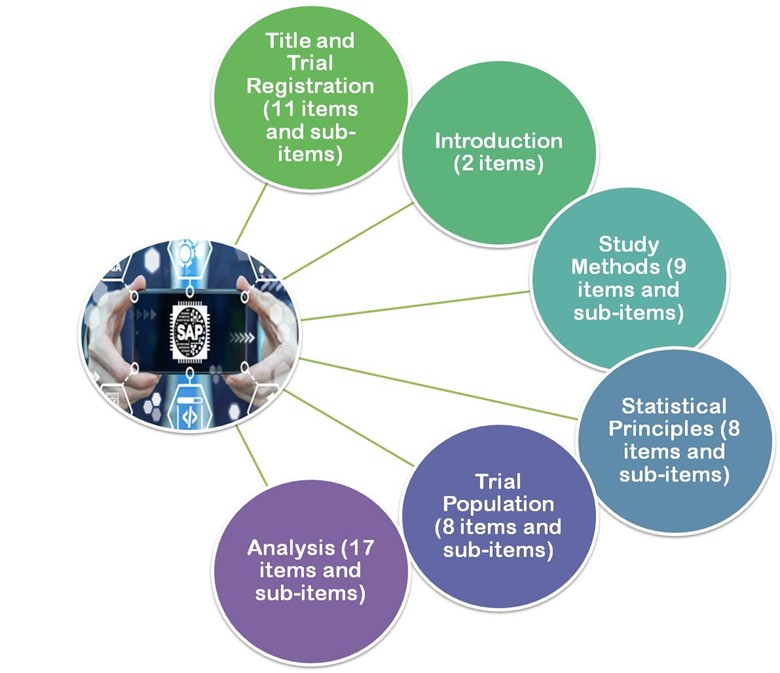
Figura 3: Gamble et al.. 2017, as diretrizes estão divididas em 6 seções principais.
4. Em que consiste um SAP?
A lista de verificação de 32 listas de verificação detalhadas para o desenvolvimento do Plano de análise estatística (SAP) Lista de verificação (Word). A intenção primária de ser mais aplicável às análises finais das TCs, bem como às TCs randomizadas de fases posteriores. As diretrizes mais importantes desenvolvidas pela FDA Orientação para a Indústria: Princípios Estatísticos para Ensaios Clínicos.
As seguintes diretrizes e recomendações para o conteúdo de um SAP:
- O SAP não é um documento independente e deve ser lido em conjunto com o protocolo de ensaios clínicos.
- O protocolo de ensaio clínico deve ser consistente com os princípios do Declaração SPIRIT 2013.
- O SAP deve ser aplicado a um conjunto de dados limpo ou validado para análise.
Diretrizes detalhadas desenvolvidas através de financiadores, autoridades reguladoras, periódicos, representantes do setor e Colaboração em Pesquisa Clínica no Reino Unido Unidades de Ensaios Clínicos registradas (UKCRC CTUs). As Diretrizes para o Conteúdo dos Planos de Análise Estatística em Ensaios Clínicos descrevem detalhadamente em JAMA. No entanto, uma explicação mais detalhada de cada lista de verificação por item pode ser encontrada no documento de elaboração. A declaração da SAP também está incluída no Rede do Equador e MRC-NIHR Trials Methodology Research Partnership (TMRP). A seguir estão os principais documentos e links utilizados no desenvolvimento do SAP em ensaios clínicos (Figura 4).
- Documento-chave
- Lista de verificação
- Elaboração
- Papel JAMA
- Links chave
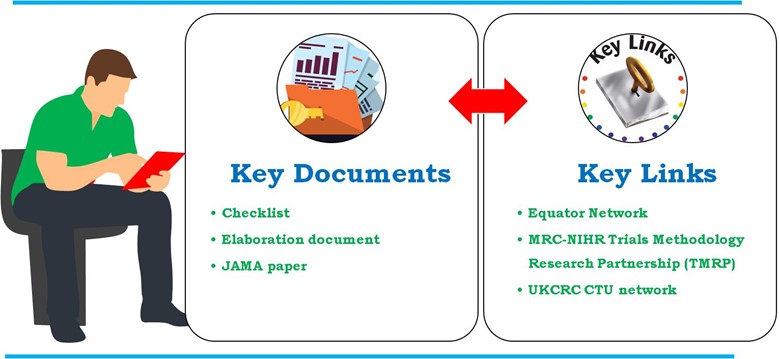
Figura 4: Principais documentos e links utilizados no desenvolvimento do SAP em ensaios clínicos
5. Contratação de um estatístico clínico freelance para ajuda com SAPs
Desenvolver um SAP muitas vezes requer o apoio de um estatístico clínico freelance. Com a ajuda de um bioestatístico experiente, você pode desenvolver um SAP completo e livre de erros, que irá melhorar a qualidade de seus testes clínicos.
Navegue consultores de ensaios clínicos em Kolabtree agora e entre em contato diretamente com um especialista.







