Mahasweta Pal, escritor médico freelance at Kolabtree, writes about ongoing ensaios clínicos to test the efficacy of convalescent plasma treatment for COVID-19.
Até hoje, Remdesivir e Favipiravir continuam sendo os únicos medicamentos disponíveis com um status de emergência aprovado pela FDA para tratar a doença coronavírus, que são aprovados e acessíveis apenas em alguns países (Estados Unidos, Itália, China e Japão). Além disso, a hidroxicloroquina e a cloroquina, que eram os medicamentos mais freqüentemente utilizados contra infecções pelo SARS-COV-2, foram associados a problemas graves de ritmo cardíaco e outro novo estudo concluiu que, embora sejam eficazes contra as doenças auto-imunes e a malária, eles não poderia mostrar qualquer benefício amelioratório significativo contra a infecção pelo coronavírus. Até mesmo o braço de ensaio SOLIDARIEDADE da Organização Mundial da Saúde baseado em hidroxicloroquina foi interrompido.
Em vários países, a população de pacientes compreende casos assintomáticos de COVID-19 e a necessidade de tratamentos contra casos leves e graves de COVID-19 aumentou consideravelmente, o que levou as grandes empresas farmacêuticas a considerar outros tratamentos sob testes clínicos, dada a emergente crise global.
Estudos anteriores sobre o tratamento de infecções por coronavírus, tais como SARS, MERS e outros doenças virais, incluindo o Ebolavirus e a gripe H1N1 A mostraram que infusão de plasma convalescente é um solução provisória viável for treating patients with life-threatening manifestations of severe acute respiratory syndrome coronavirus 2 (SARS-COV-2) coronavirus disease. Therefore, here is a brief look at how this biological intervention is helping in the pandemic management in saúde systems worldwide.
Ensaios clínicos em Terapia Plasmática Convalescente
Nos 96 ensaios em execução global, o plasma convalescente (CP) contendo anticorpos para o SARS-CoV-2 está sendo estudado como um tratamento investigativo para pacientes com COVID-19. O tratamento com CP ou imunoglobulina hiperimune tem sido restrito principalmente a projetos com um único braço. Até agora, 56200+ pacientes foram recrutados para testes enquanto o recrutamento permanece aberto na maioria dos centros. A medida de resultado mais comum em cada ensaio é a mudança na pontuação da Avaliação Sequencial de Falhas Orgânicas (SOFA) medida 1, 3, 7, e 28 dias após a administração da CP no Dia 0 do ensaio. Os critérios de inclusão para ensaios de PC são pacientes adultos gravemente doentes, pacientes com complicações moderadamente graves, incluindo insuficiência respiratória e/ou multissistêmica, e pacientes com uma apresentação clínica moderada, mas com comorbidades a longo prazo, incluindo diabetes, hipertensão, ou condições reumatóides.
Um estudo crítico envolvendo 10 pacientes gravemente doentes da COVID-19 de 3 hospitais diferentes em Wuhan sugeriu que a transfusão de CP de alta intensidade pode neutralizar efetivamente a SRA-CoV-2, levando a respostas inflamatórias impedidas e melhorando as condições dos sintomas sem eventos adversos graves.
Início Estudos da Fase I realizado em vários hospitais em toda a China concluiu que a administração de CP melhorou os sintomas respiratórios em 3-5 dias após a transfusão. Em outro estudoOs pacientes tinham melhorado os escores SOFA e reduzido a carga viral após receberem o PC combinado com metilprednisolona, ventilação mecânica e agentes antivirais. O tratamento foi capaz de proporcionar recuperação da SDRA em 12 dias, mostrando assim a aplicabilidade da PC em uma coorte de pequenos pacientes criticamente doentes com COVID-19 e SDRA.
Um julgamento em andamento na Colômbia está testando a eficácia do plasma convalescente com hidroxicloroquina versus hidroxicloroquina em pacientes internados com COVID-19. Os investigadores estão procurando avaliar as mudanças na carga viral em períodos de 1, 4, 7, 14 e 28 dias, e o desenvolvimento de anticorpos IgM e IgG como medidas de resultado primário e redução do período de hospitalização e admissão na UTI como medida de resultado secundário. O NIH também tem iniciou um ensaio clínico to collect plasma from adult patients who have recovered from the disease. Interested plasma donors can also look at this nationwide resource by the NIH and US Saúde Pública and pandemic response team dedicados aos centros médicos permitindo a coleta segura de plasma.
Diretiva da USFDA sobre o uso clínico investigacional do Plasma Convalescente
O tratamento deve ser administrado apenas como uma intervenção de emergência através de ensaios clínicos, Aplicações de Acesso Expandido IND (a disposição da FDA para pacientes que não puderam ser incluídos em ensaios clínicos), e o IND de Emergência de Paciente Único (COVID-19 pacientes excluídos dos ensaios, mas em sérias condições de risco de vida) solicitado pelos médicos chefes do hospital ou centro médico.
O USFDA é rigoroso com a administração da PC porque esses estudos clínicos representam o risco de expor os pacientes a antígenos potencialmente imunogênicos que complicarão futuras transfusões, e colocarão os pacientes em risco de reações transfusionais. Além disso, o uso de plasma padrão como braço de controle, que carrega muitos dos mesmos riscos de PC mas nenhum de seus benefícios, pode mascarar alguns dos riscos de uso de PC que poderiam ser detectados de outra forma.
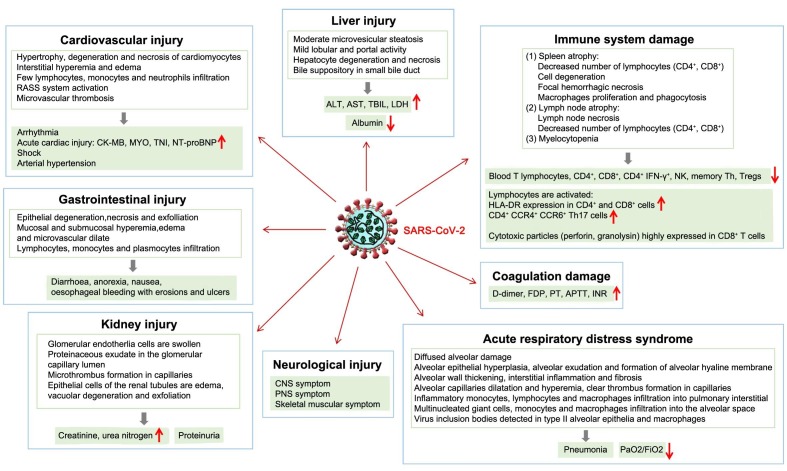
Mecanismo da Terapia de Infusão de Plasma Convalescente
Componentes sanguíneos convalescentes são derivados do soro ou sangue total de pacientes que apresentaram recuperação da infecção específica (neste caso COVID-19) e são considerados como a fonte de anticorpos neutralizantes da SRA-CoV-2. Historicamente, a imunoterapia passiva tem envolvido sangue total convalescente, plasma convalescente, imunoglobulina humana combinada para administração intravenosa ou intramuscular, imunoglobulina humana de alto teor e anticorpos policlonais ou monoclonais. Entretanto, o plasma coletado por aférese é atualmente a terapia preferida. Os produtos sanguíneos convalescentes têm um longo histórico de segurança; entretanto, eles podem aumentar o risco de aumento de infecção dependente de anticorpos (ADE), um fenômeno que pode tornar uma pessoa suscetível à infecção com outros vírus na presença de anticorpos.
Apesar da evidência de longa data do uso de PC ou imunoglobulina hiperimune, sua eficácia clínica permanece pouco clara com conclusões fracas, provavelmente porque a PC foi usada apenas em situações críticas, durante epidemias/pandêmicas maciças, exigindo ações imediatas. A eficácia da terapia de PC parece ser diferente dependendo dos protocolos patogênicos e de tratamento (por exemplo, tempo, volume e dosagem da administração).
Since this is one of the few available viable treatments under application against the 2019-nCoV, there is an impending need for governments to formulate saúde practice guidelines. Guidelines that ensure biosafety of collected medicinal and biological products, their storage and overall safety, and preventing contamination have yet to be set in place. Um comentário chave do USFDA em colaboração com pesquisadores de outros importantes COVID-19 instituições também destaca a necessidade de países de baixa e média renda assegurarem que um suprimento adequado de componentes sanguíneos de qualidade e seguros seja mantido para transfusão, o que é essencial para atender às necessidades primárias de saúde da população. As respostas à epidemia COVID-19 restabelecem a importância da construção de um sistema nacional de sangue organizado e sustentável, enquanto são tomadas medidas para fornecer plasma convalescente COVID-19 adequadamente coletado, testado e processado para uso clínico investigacional.
O uso imediato do plasma convalescente permite um método promissor de gerenciamento de pacientes COVID-19 enquanto vacinas e tratamentos específicos são avaliados e trazidos à escala. CP de doadores que se recuperaram da COVID-19 é considerado como o mais promissor quando usado como profilaxia ou quando administrado logo após o início dos sintomas (dentro de 14 dias). A imunidade é considerada como durando de semanas a meses.