Kolabtree freelance biostatistician consultant, ルドラ・パテル provides a comprehensive guide on how to develop a Statistical Analysis Plan (SAP) for 臨床試験.
1.臨床試験(CT)における統計解析計画(SAP)
を高めるためには、よく書かれた完全な統計分析計画(SAP)が重要です。 臨床試験の質 と、より有効で一般化されたものにしています。
SAP is a defined outline of the planned statistical basic/advance methods for the analyses for a clinical trial and is written in study protocol as well as separately. SAP is crucial and is one of the key Regulatory confidential documents in the development of a clinical trial. An SAP is a more challenging task in a clinical trial protocol development that requires a strong command on statistical methodology, medical terminology and visualization power. It provides explicit guidance on statistical programming and the presentation of results for clinical trial. The following four important types of SAP are used in a clinical trial (Figure 1).
- データモニタリング
- 中間統計解析
- 統合統計解析計画
- 臨床試験の統計解析計画
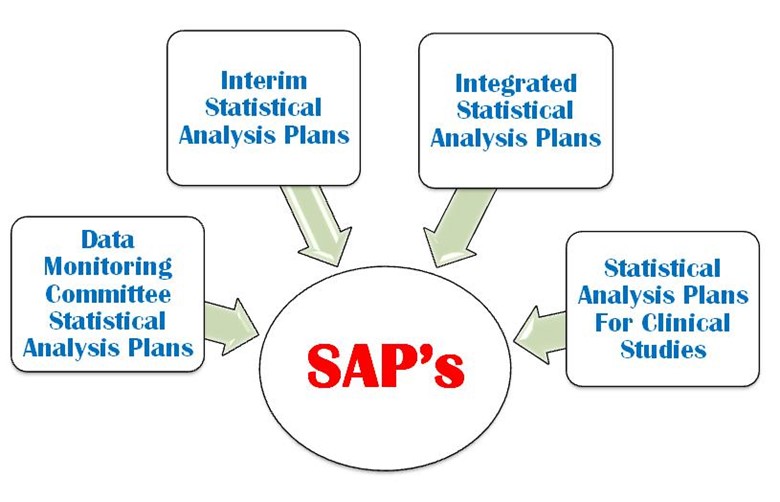
図1:CTでは4つの重要なタイプのSAPが使われている
The SAP is mostly written as a separate document or it is included in CT study protocol as a standard operating procedure for dealing with the statistical part of the clinical study. A team メディカルスタティシャン/biostatistician is in-charge of developing the SAP in coordination with the principal investigator of the CT study. The document should be reviewed by Senior Biostatistician and finalized before to submission to the review board and regulatory authorities. If any protocol amendments are done, then the SAP is amended as well.
The SAP must properly explain following the aims and primary objectives, secondary objective, exploratory objectives, primary/secondary/exploratory endpoints, trial population, design of the trial, sample size calculations with justifications/assumptions, and the randomization methods. Additionally, an SAP must describe in detail the statistical methodology i.e. efficacy analysis, safety データ分析, reporting conventions, etc. Figure 2 shows the most important points that need to be considering when developing SAP in the clinical trial study protocol.
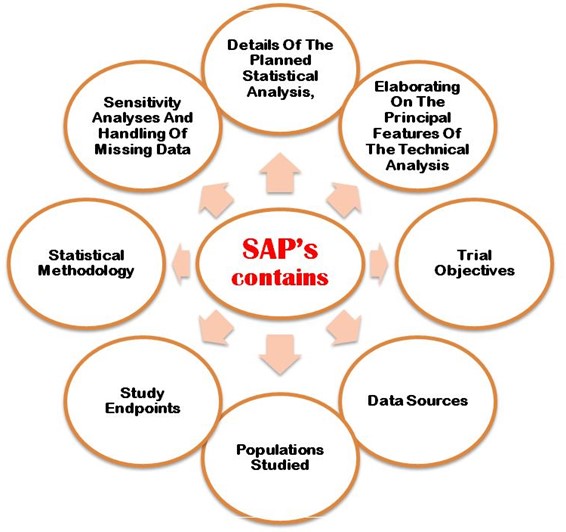
図2:CTプロトコルでSAPを開発する際に考慮すべき重要なポイントの詳細。
作成された解析計画は、当局によるデータベースロックの前に、特別な注意を払って検討され、上級盲検生物統計学者によって承認されなければなりません。 Ahrweiler et al. オンラインで発表された学会論文では、統計解析計画の見直しの重要性が説明されています。CTプロトコルでSAPを作成する際に考慮すべき重要なポイントを以下に詳述します。
- 予定されている統計解析の詳細
- テクニカル分析の主な特徴を詳しく説明しています。
- 試験の目的
- データソース
- 調査対象者
- 試験のエンドポイント
- 統計手法
- 感度解析と欠損データ
臨床試験のSAPは、試験責任者と統計担当者の間で綿密な話し合いをしながら作成する必要があります。以下は、統計担当者の役割と責任である。
- を書くことです。 リサーチ statement or hypothesis of the clinical trial study.
- プライマリーエンドポイントとセカンダリーエンドポイントを決定する。
- 臨床試験におけるバイアスとサンプルサイズの選択を減らすための戦略を見つけ出し、開発する。
- 臨床試験データ解析のための適切な統計手法をすべて定義すること
臨床試験におけるSAPの開発では、詳細なキーハイライトポイントを説明する必要があります。Yuan et al.2019では、特集記事として"統計解析プランのご案内"[図2]を参照してください。この論文では、実際の臨床試験研究のSAPを詳細に説明し、効果的なSAPを書くための実践的な詳細ガイドを提供しています。さらに同論文では、SAPのどこに、何を、なぜ、いつ、誰が、そしてSAPの重要な内容を強調するのかについても論じています。臨床試験研究では、特に規制当局の研究のために、よく書かれ、文書化されたSAPの必要性があります。
2.臨床試験における統計解析計画の重要性
CTは、すべての新しい医薬品開発プロセスおよび医療機器に対して実施されます。この10年間で、医薬品開発のための臨床試験に採用される患者の割合は、欧米だけでなく、発展途上国からも増加しています。
臨床試験において、SAPは非常に重要な文書の一つです。SAPは、事前に計画されたすべての試験仮説を評価するための分析が、科学的に妥当な方法で実施され、すべての決定が文書化されていることを保証します。また、結果をどのように発表し、CTで報告するかについても詳細に記載されています。
臨床試験は、医療における追加的な利益を評価し、介入を改善するために使用されます。 ヘルスケア. The more important thing to consider while conducting a clinical trial is to execute the trial with minimum bias. Therefore, each clinical trial to have a clear and detailed SAP to its support to reproducibility. For the best practice of CT scientific research studies, reproducibility of research, and to avoid concerns of misuse of clinical research, a clear detailed and very transparent SAP much be needed, to improve trial conduct and reporting. Following are three essential roles of SAP needs to maintain in conducting CT.
- 透明性。 適用される手法を事前に明示することで、分析の進め方を透明化すること
- コミュニケーションです。 研究の進め方について、研究に関わるすべての人に明確に伝えること
- レプリケーションです。 複製を容易にすることで、将来の研究チームが同じステップを踏んで、同じサンプルまたは新しいサンプルで結果を確認することができます。
標準的なガイドラインとベストプラクティスに従って、臨床試験プロジェクトの統計担当者/生物統計担当者は、臨床試験開始前に、計画されたすべての分析、分析セットの定義を含む試験パラメータ、基本的/高度な統計手法を詳細に記載した試験SAPを作成することが重要です。
また、CTのSAPに関連するその他の重要な検討事項は以下の通りです。
- バイアスを最小限に抑える方法の一つとして、Biostatisticianの目をつぶることがあります。
- SAPは、実行されたすべてのデータ操作と分析を再現できるように文書化する必要があります。
- Trial Master Fileは、Biostatisticianによって、試験終了時にすべての関連文書とともに維持されることが要求されます。
体系的に配置された分析計画は、臨床試験チームが一緒に同じページを見ていることを助け、CTにもう一つの具体性を加えます。SAPは、臨床試験研究の体系的に計画された統計手法を記述したものである。臨床試験のプロトコルと比較して、SAPは、試験デザインと臨床試験データの分析のための詳細な統計手法を記載した詳細な技術文書です。SAPを作成する際には、一般的にICH E3およびE9ガイドラインに従います。これにより、SAPの各セクションの内容を把握することができます。しかし、E3とE9には特定の統計手法は明記されていません。
臨床試験における再現性、透明性、妥当性を向上させるために米国国立衛生研究所(NIH)は、「臨床試験の登録および結果情報の提出に関する規則」を発表し、臨床試験の登録、ClinicalTrials.govへの臨床試験中の募集や結果の掲載、臨床試験研究計画書とは別のオリジナル文書である統計解析計画書(SAP)の提出を義務付けています。
医療統計家/生物統計家の大きな貢献は、標準的なSAPの開発の他に、臨床試験データの設計、モニタリング、分析にあります。
3.臨床試験におけるSAPの詳細なチェックリスト/ガイドライン
CTのSAPを開発する際には、詳細なチェックリストや標準的なガイドラインをすべて考慮する必要がある。SAPの開発に使用される重要なガイドラインは、ICH E9(International Conference for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use)およびSPIRIT(Standard Protocol Items: Recommendations for Interventional Trials)である。
透明性と再現性は、臨床試験データの価値を高める基本的な用語である。しかし、統計的手法の影響は、臨床試験の意思決定に直接影響するため、文書化され、機密性が保たれ、透明性のある統計的行為が不可欠です。専門家である医学統計学者/生物統計学者は、標準的なガイドラインに沿ったSAPの開発を支援します。
ICH E9では、SAPは通常報告分析計画として知られているが、他の組織ではデータ分析計画(DAP)または統計分析計画(SAP)と呼ばれることもある。ICH E9ガイドラインでは、"最終的なデータのSAPの主な特徴は、プロトコルの統計セクションに記載されるべきである "とされている。しかし、SPIRIT(Standard Protocol Items: Recommendations for Interventional Trials)ガイドラインでは、別個のSAPについて言及している。
SAPは、規制当局への報告が必要なCTにおいて、最も重要な文書です。FDA)、欧州医薬品庁(European Medicines Agency)EMA)).標準的なガイドラインでは、SAPは機密性の高い臨床試験マスターファイルに保存する必要があるとされており、規制当局による監査の際に、統計文書が標準的なガイドラインに正確に従っているかどうかをチェックするために使用されます。
SAPは、統計家を指導するための最も一般的な文書である。一般的に、SAPには以下の項目を含める必要があります(図3)。
統計担当者を紹介してください。 のです。 CONSORT声明 (および任意の拡張子)、さらに ICH E9 臨床試験の統計的原則 (PDF, 325 KB).
- トライアルプランニング&デザインステーション
- EQUATORネットワーク- 健康調査研究の優れた報告のためのリソースセンターです。
- CONSORTのウェブサイト
- 2017年に発表されたガイドラインでは Gamble et al.2017年、これらの論文のガイドラインでは、SAPのフォローアップを展開する際に考慮すべき重要な項目として、最低55項目を推奨しています。
- タイトルと登録
- はじめに
- 調査方法
- 統計的原理
- 試験対象者
- 分析
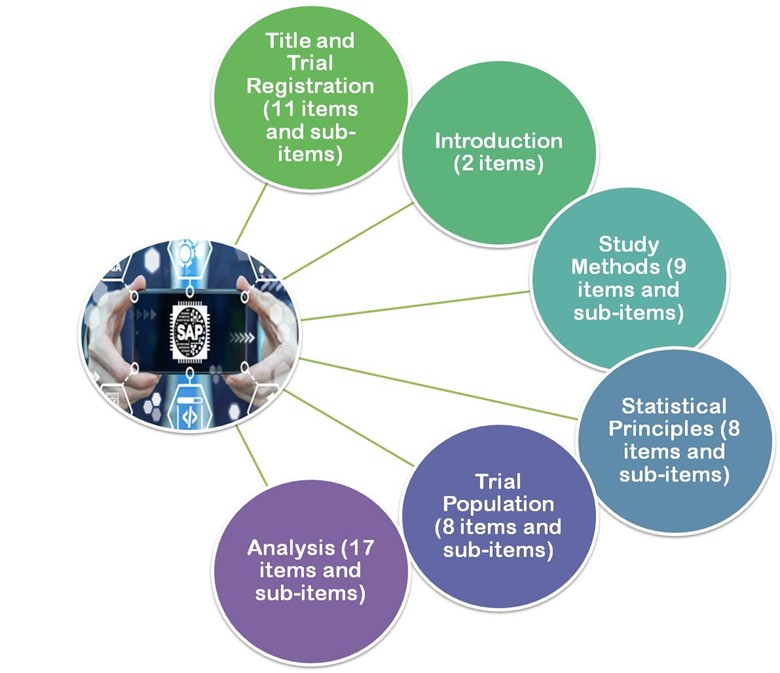
図3. Gamble et al.2017年版のガイドラインは、大きく6つのセクションに分かれています。
4.SAPは何で構成されているのですか?
A チェックリスト を開発するための32の詳細なチェックリストの 統計解析計画(SAP)チェックリスト(Word).後期無作為化CTだけでなく、CTの最終解析にもより適用できることを第一の意図としています。が作成した最も重要なガイドラインは、FDAの ガイダンス・フォー・インダストリー臨床試験の統計的原則.
SAPの内容については、以下のガイドラインと推奨事項があります。
- SAPは単独の文書ではなく、臨床試験プロトコルと併せてお読みください。
- 臨床試験のプロトコルは、以下の原則に沿ったものでなければなりません。 SPIRIT 2013年ステートメント.
- SAPは、分析のためのクリーンなデータセットまたは検証済みのデータセットに適用されます。
資金提供者、規制当局、ジャーナル、業界の代表者との間で作成された詳細なガイドライン。 UKクリニカル・リサーチ・コラボレーション登録臨床試験ユニット (UKCRC CTU)を参照してください。The Guidelines for the Content of Statistical Analysis Plans in Clinical Trials(臨床試験における統計解析計画の内容に関するガイドライン)の詳細は以下の通りです。 JAMA.ただし、各チェックリストの項目ごとのより詳細な詳細説明は 推敲資料.また、SAPのステートメントも含まれています。 エクエーターネットワーク そして MRC-NIHR トライアル方法論研究パートナーシップ(TMRP.以下は、臨床試験でSAPを開発する際に使用された主要文書と主要リンクです(図4)。
- キードキュメント
- チェックリスト
- 精緻化
- JAMA論文
- 主なリンク
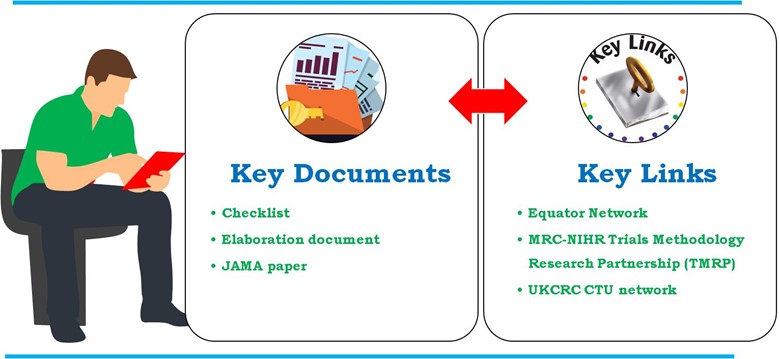
図4:臨床試験でSAPを開発する際に使用した主要文書と主要リンク
5.フリーランスの臨床統計家を雇ってSAPのサポートをしてもらう
SAPの開発には、多くの場合、フリーランスの臨床統計家のサポートが必要です。経験豊富な生物統計学者の助けを借りれば、完全でエラーのないSAPを開発し、臨床試験の質を向上させることができます。
閲覧 臨床試験コンサルタント 今すぐKolabtreeにアクセスして、専門家と直接連絡を取ってみてください。







