A 臨床評価報告書(CER is a technical document required by 医療機器 companies that want to sell or distribute products in Europe. The CER provides a comprehensive overview of the 医療機器 design and composition, intended usage and applications, 臨床試験 解析と結果、関連する文献レビュー、プロトコル、使用説明書。
EU MDRとCEマーキング
Medical devices in Europe need to get a “CE Mark”, which indicates that the product complies with the EU regulations (MDD, MDR or IVDR, whichever is applicable). The recent Medical Device Regulations in Europe has significantly impacted the way medical devices are regulated and approved in the EU. The MDR is the biggest change to medical device legislation in over 20 years. Some major changes in the MDR (as compared with the MDD) include device classification, technical file documentation, traceability and post-market surveillance.
続きを読む 医療機器にCEマークを取得するためのヒント
臨床評価レポート
The MDR places great emphasis on Clinical Evaluation Reports or CERs. The CER forms part of the Technical File, which is the main documentation which demonstrates 規制遵守 and provides all the information about the device. Medical device companies need to take several measures to make sure that their CER is well-prepared and well-maintained. CER documentation typically comprises 4 stages:
- 機器の範囲、使用目的、治療/診断上の主張の定義
- 臨床データの識別と妥当性の確認
- データを分析し、要件をすべて満たしているかどうかを解釈する
- 市販後調査(PMS)中に回答が得られる可能性のあるリスクと不確実性の特定
CERは、医療機器のライフサイクルを通じて定期的に更新する必要があります。 この文書には、MEDDEV 2.7/1 Rev.4 Annex 1(MDR の安全及び性能要件)の必須要件(ER)への適合性の証明を裏付ける臨床的証拠が含まれるべきである。また、本文書には、機器の物理的・技術的側面及び構成を、使用説明書とともに記載する。
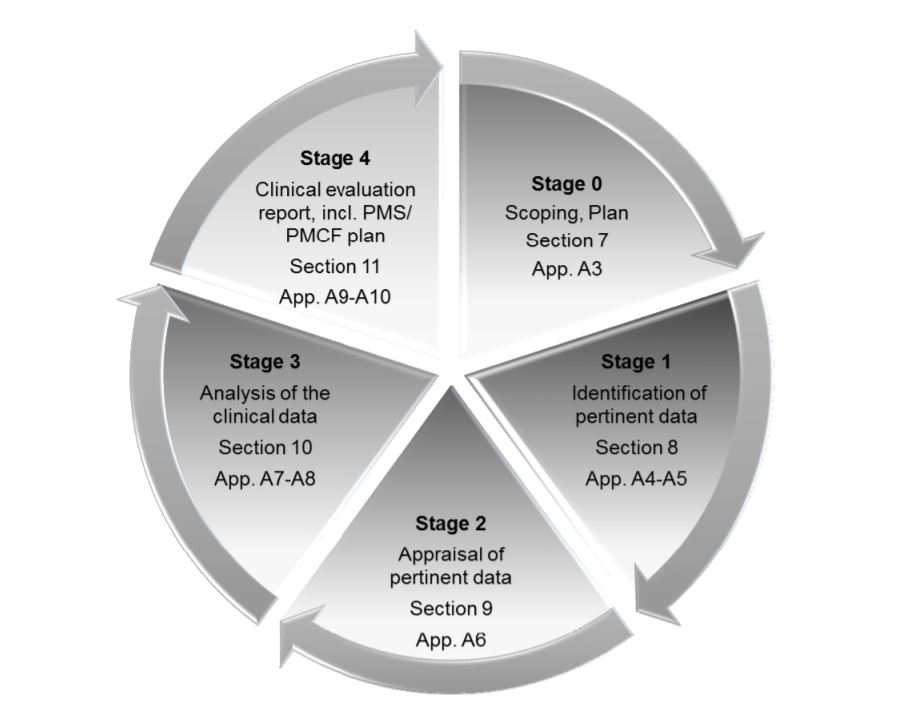
で説明されているCERの4つのステージ。 MEDDEV 2.7/ rev.4.
同等性
医療機器メーカーは、自社の医療機器や、安全性や臨床性能が変わらない同等の機器の臨床データを評価する必要があります。MDRでは、医療機器メーカーは、製品が同等であることを証明するために、生物学的、技術的、臨床的の3つの要素を考慮しなければならないとされています。
技術的同等性 とは、機器の設計仕様や構成が同じであり、同じ条件で、同じ展開方法や動作原理で使用されなければならないことを意味します。 臨床的同等性 とは、身体の同じ場所で、同じ集団に対して、同じ症状を治療するために使用され、同様の性能を達成しなければならないということです。
生物学的同等性 とは、当該医療機器が生物学的リスクを引き起こさないことを意味します。
医療機器が同等性を証明できない場合、さらなる臨床調査を行うか、製品からクレームを削除しなければなりません。
文献調査
文献調査の結果は、臨床評価報告書の中核をなすものです。デバイスに関連するすべての出版された文献に簡単にアクセスでき、主張を裏付けることができるよう、強力な文献調査プロセスを確立する必要があります。文献レビューには、一般的に、正しい検索用語を特定し、PubMEDやMEDLineなどのデータベースを使用し、関連する文献を見つけ、関連する参考文献を使用するなどして評価することができる熟練した研究者の専門知識が必要です。また、文献レビューでは、臨床データでは答えられない疑問点を解決する必要があります。
CERの作成にはどのくらいの時間がかかりますか?
CERに必要なすべてのデータを特定・収集し、ガイドラインに沿って文書を作成するには、数週間から数ヶ月を要します。CEマーク取得後も、市販後調査(PMS)はプロセスの大部分を占めており、PMSはメーカーの品質管理システム(QMS)の中核を成すものでなければなりません。また、PMSはメーカーの品質管理システム(QMS)の中核をなすものです。場合によっては、市販後の臨床データを積極的に収集し、安全性と性能の要件を満たすかどうかを評価するPMCF(Post-Market Clinical Followup)が必要になります。
CERは静的な文書ではありません。医療機器メーカーは、EUでの市場アクセスを維持し、製品のリコールを回避し、ドキュメントの維持に使われる時間とリソースを合理化するために、グッドプラクティスを取り入れた強固なプロセスと戦略を開発することが推奨されます。
CERライティングをフリーランスの専門家に委託することで、貴重な時間とエネルギーを節約することができます。 フリーランスの臨床評価レポート作成者 は、Kolabtreeで3,000米ドルからのCERを開発することができます。
臨床評価報告書作成者
The time and expertise required to put together a CER can be a resource strain for several medical device startups or medical device SMBs, who may not have in-house specialists. Working with external experts, including freelance CER writers, clinical data analysts, literature review experts biostatisticians and メディカルライター can help companies make sure that their CER strategy is robust and their data is all verified and accurate.
フリーランスのCERライターを雇うには
CERライターに求められるスキルは、医療機器の規制や承認プロセスを扱った経験、MEDDEV 2.7/ rev.4に精通していること、治療分野に関する知識、強い分析能力などです。4に精通していること、治療領域に関する知識、優れた分析能力などが挙げられます。 Kolabtreeのグローバルな専門家集団には、以下のような資格を持つ人がいます。 臨床評価報告書作成者は、あなたが十分に調査した上でCERをまとめるお手伝いをします。あなたのプロジェクトを投稿して、専門家から見積もりをもらうのは無料です。 スタート
関連する専門家
医療機器コンサルタント | フリーランスのメディカルライター | フリーランスのCERライター | EU MDRコンサルタント | FDA提出書類 | 文献検索のエキスパート | 規制遵守のエキスパート | クリニカル・トライアル・エキスパート | レギュラトリー・ライター | PMSコンサルタンツ | PMCFコンサルタンツ | 生物統計学の専門家 | 製品開発エキスパート







