A rapporto di valutazione clinica (CER) is a technical document required by dispositivo medico companies that want to sell or distribute products in Europe. The CER provides a comprehensive overview of the dispositivo medico design and composition, intended usage and applications, studi clinici analisi e risultati, revisioni della letteratura, protocolli e istruzioni per l'uso.
EU MDR e marchio CE
Medical devices in Europe need to get a “CE Mark”, which indicates that the product complies with the EU regulations (MDD, MDR or IVDR, whichever is applicable). The recent Medical Device Regulations in Europe has significantly impacted the way medical devices are regulated and approved in the EU. The MDR is the biggest change to medical device legislation in over 20 years. Some major changes in the MDR (as compared with the MDD) include device classification, technical file documentation, traceability and post-market surveillance.
Leggi di più: Suggerimenti per ottenere un marchio CE per il tuo dispositivo medico
Rapporto di valutazione clinica
The MDR places great emphasis on Clinical Evaluation Reports or CERs. The CER forms part of the Technical File, which is the main documentation which demonstrates conformità normativa and provides all the information about the device. Medical device companies need to take several measures to make sure that their CER is well-prepared and well-maintained. CER documentation typically comprises 4 stages:
- Definire il campo di applicazione del dispositivo, la sua destinazione d'uso e le indicazioni terapeutiche/diagnostiche
- Identificazione e convalida dei dati clinici
- Analizzare i dati e interpretarli per vedere se soddisfano tutti i requisiti
- Identificare i rischi e le incertezze, a cui si può rispondere durante la sorveglianza post-commercializzazione (PMS)
Un CER deve essere regolarmente aggiornato durante tutto il ciclo di vita di un dispositivo medico. Il documento dovrebbe contenere l'evidenza clinica che supporta la prova di conformità ai requisiti essenziali (ER) in MEDDEV 2.7/1 Rev. 4 Allegato 1 (Requisiti di sicurezza e di prestazione nella MDR). Il documento dovrebbe anche descrivere gli aspetti fisici e tecnici e la composizione del dispositivo, insieme alle istruzioni per l'uso.
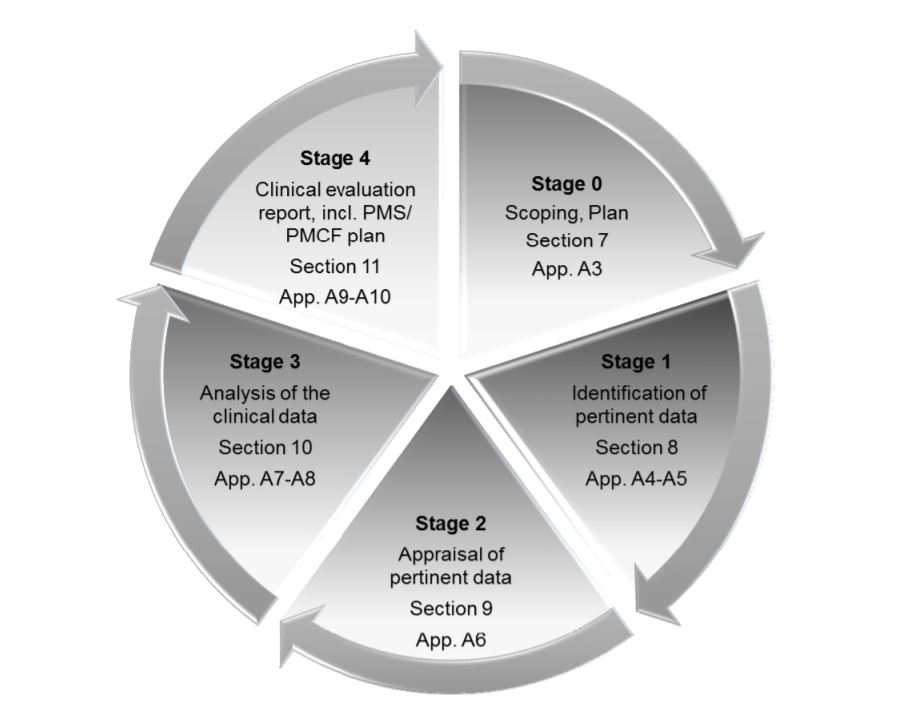
Le quattro fasi del CER come delineate in MEDDEV 2.7/ rev. 4.
Equivalenza
I produttori di dispositivi medici devono valutare i dati clinici del proprio dispositivo medico o di un dispositivo equivalente, la cui sicurezza e performance clinica non è diversa. Secondo la MDR, il produttore di dispositivi medici deve considerare tre fattori per dimostrare che un prodotto è equivalente: biologico, tecnico e clinico.
Equivalenza tecnica significa che il dispositivo deve avere le stesse specifiche di progettazione e composizione, e deve essere utilizzato nelle stesse condizioni, con lo stesso metodo di spiegamento e principi operativi. Equivalenza clinica significa che il dispositivo deve essere utilizzato per trattare la stessa condizione, nella stessa posizione nel corpo e per lo stesso gruppo di popolazione, ottenendo prestazioni simili.
Equivalenza biologica significa che il dispositivo medico in questione non dovrebbe causare alcun rischio biologico.
Se un dispositivo medico non è in grado di dimostrare l'equivalenza, deve eseguire ulteriori indagini cliniche o rimuovere il claim dal suo prodotto.
Rassegna della letteratura
I risultati della ricerca della letteratura costituiscono una parte fondamentale del rapporto di valutazione clinica. Un forte processo di revisione della letteratura deve essere stabilito in modo che tutta la letteratura pubblicata rilevante per il dispositivo sia facilmente accessibile e possa sostenere l'affermazione fatta. Le revisioni della letteratura richiedono tipicamente l'esperienza di un ricercatore esperto che possa identificare il termine di ricerca corretto, usare database come PubMED o MEDLine, trovare la letteratura rilevante e valutarla, usando anche i riferimenti pertinenti. La revisione della letteratura dovrebbe anche affrontare qualsiasi domanda a cui i dati clinici non sono in grado di rispondere.
Quanto tempo ci vuole per scrivere un CER?
Identificare e raccogliere tutti i dati che vanno nel CER e preparare il documento secondo le linee guida può richiedere diverse settimane o mesi. La sorveglianza post-commercializzazione (PMS) costituisce una grande parte del processo anche dopo la certificazione del marchio CE, e la PMS deve essere una parte fondamentale del sistema di gestione della qualità (QMS) del produttore. Alcuni casi richiedono anche il Post-Market Clinical Followup (PMCF) che comporta la raccolta proattiva di dati clinici e la loro valutazione per soddisfare i requisiti di sicurezza e performance.
Il CER non è un documento statico. Si raccomanda ai produttori di dispositivi medici di sviluppare un processo robusto e una strategia che incorpori le buone pratiche per aiutarli a mantenere l'accesso al mercato dell'UE, evitare qualsiasi richiamo del prodotto e ottimizzare il tempo e le risorse utilizzate per mantenere il documento.
Esternalizzare la scrittura del CER a un esperto freelance può aiutare a risparmiare tempo ed energia preziosi. Scrittori freelance di rapporti di valutazione clinica sono in grado di sviluppare CER a partire da 3.000 dollari su Kolabtree.
Scrittori di rapporti di valutazione clinica
The time and expertise required to put together a CER can be a resource strain for several medical device startups or medical device SMBs, who may not have in-house specialists. Working with external experts, including freelance CER writers, clinical data analysts, literature review experts biostatisticians and scrittori medici can help companies make sure that their CER strategy is robust and their data is all verified and accurate.
Come assumere uno scrittore freelance CER
Le competenze da ricercare in uno scrittore di CER includono l'esperienza nella gestione dei regolamenti e dei processi di approvazione dei dispositivi medici, la familiarità con MEDDEV 2.7/ rev. 4, conoscenza delle aree terapeutiche e forti capacità analitiche. Il pool globale di esperti di Kolabtree comprende esperti qualificati Scrittori di rapporti di valutazione clinicache può aiutarti a mettere insieme un CER ben studiato e completo. È gratuito pubblicare il tuo progetto e ottenere preventivi da esperti. Iniziare
Esperti correlati:
Consulenti di dispositivi medici | Scrittore medico freelance | Scrittore freelance CER | Consulenti MDR dell'UE | Presentazioni FDA | Esperti di ricerca della letteratura | Esperti di conformità normativa | Esperto in studi clinici | Scrittori normativi | Consulenti PMS | Consulenti PMCF | Esperti di biostatistica | Esperto di sviluppo del prodotto







