Shrinidh Joshi, consulente medtech on Kolabtree, provides 3 tips for successful dispositivo medico sviluppo che vi aiuterà a portare rapidamente il vostro prodotto sul mercato.
When you have an idea (either on a back of a ‘napkin’ or still brainstorming) for the development of a new medical device, it is very much likely that your idea will be disruptive like ‘no other’ and it will have a significant impact on the assistenza sanitaria or it is just another way to look at the things. There is also a possibility that your product will help to resolve some of the current challenges for example ‘form factor’ and bulkiness of the spirometer device was a huge challenge until the discovery of portable, hand-held spirometer devices. Similarly, the discovery of blood glucose monitors was transformative like no other for millions of diabetics.
Non è necessario progettare un dispositivo medico che sia straordinario o dirompente, un dispositivo medico che può aggiungere valore agli utenti esistenti detiene anche le possibilità di fornire benefici all'utente come il software come un dispositivo medico come BlueStar [1] che aiuta nella gestione dello stile di vita e dei farmaci per i diabetici. Il più grande dilemma per una startup di dispositivi medici è se il loro dispositivo sarà in grado di catturare una quota redditizia nel mercato. Il più delle volte l'enigma deriva dal controllo di qualità o dalla validità del dispositivo medico o dalla complessità di portare un dispositivo medico sul mercato. Per le startup di dispositivi medici, direi che senza avere esperti che vi guidino durante tutto il processo, entrambi possono portare al deragliamento del vostro progetto. In alcuni casi, se avete progettato un dispositivo medico che ha il potenziale per sconvolgere il mercato e portare nuovi modi di vedere il trattamento, forse non avete pensato ai requisiti normativi che quel tipo di dispositivo potrebbe avere, o forse le agenzie di regolamentazione non sono in grado di classificare il vostro dispositivo. Sono stato partner di un'azienda che ha avuto una brillante idea di combinare un dispositivo terapeutico con un dispositivo diagnostico per fornire benefici end-to-end all'utente finale, tuttavia, la confusione per l'agenzia di regolamentazione era di rivedere quel dispositivo come un farmaco o sotto 510(k) come un dispositivo diagnostico. Pertanto, un approccio olistico che consideri tutti gli aspetti della validità del design, del controllo di qualità e del quadro normativo è un approccio più saggio piuttosto che affrontarli come e quando necessario. Richiede precisione in ogni fase - dall'ideazione del prodotto alla progettazione e allo sviluppo, alla conformità, ai test, allo scale-up e alla commercializzazione del prodotto.
In questo articolo, daremo uno sguardo alla fase di progettazione e sviluppo del processo di sviluppo dei dispositivi medici. Questa fase, come si può pensare, è la più importante nel ciclo di vita del dispositivo medico. Come startup di un dispositivo medico, se si tralascia qualche passo chiave nella definizione o nella progettazione del dispositivo medico, si può rischiare la non conformità con le agenzie di regolamentazione e il dispositivo non sarà in grado di arrivare sul mercato. Anche se riuscite a bypassare gli ostacoli normativi per un dispositivo definito o progettato in modo poco accurato, alla fine potrebbe non riuscire a soddisfare le sue richieste sull'uso previsto o sui benefici rispetto ai suoi predecessori o concorrenti. D'altra parte, un prodotto ben definito e progettato ha un sacco di potenziale per le sue affermazioni sull'interruzione del mercato e l'eventuale adozione del mercato.
Come per ogni prodotto sanitario, sia esso un farmaco o un dispositivo medico, è necessaria una notevole quantità di sforzi e meticolosità per fornire la giusta soluzione che possa soddisfare le richieste del cliente. Come startup di un dispositivo medico, è necessario assicurarsi che tutte le parti interessate siano allineate con lo scopo del prodotto, i risultati, la definizione, le specifiche, il design e il fattore di forma, la strategia di mitigazione del rischio e i requisiti normativi. Essenzialmente, tutti gli sforzi di cui sopra dovrebbero essere diretti verso la migliore qualità possibile per il vostro dispositivo medico.
Sviluppo di dispositivi medici: Dal prodotto alla fase di scoperta
1. Ideazione e concettualizzazione del prodotto
The first step in medical device innovation is to analyze and identify the medical device market. As mentioned above, you are analyzing to see if your device is meeting unmet medical needs like early diagnosis of a difficult to cure disease or it is providing a more efficient way to manage a chronic disease. The problem statement for your medical device could be a novel or a better way to monitor adherence to the treatment regimen, monitoring ailment and health, improving drug delivery minimizing the drug requirements and adverse drug events, using intelligenza artificiale, apprendimento automatico, deep learning, or real-world insights etc. Innovative software can also be defined and approved as a medical device under a software as a medical device (SaMD) category.
Identificare il bisogno con la domanda è un passo primario per creare un'offerta di dispositivi medici, oltre ad essere pronti per la conformità. Il successo di questo dipende molto da due cose:
- Il divario tra il bisogno del mercato di destinazione e quello che lo sviluppatore di dispositivi medici percepisce come bisogno; minore è il divario, migliori sono gli input per la definizione del prodotto;
- Una forte definizione del prodotto viene estratta analizzando i bisogni del mercato.
L'intero processo di sviluppo di un dispositivo medico può essere semplificato come nella figura 1 mostrata qui sotto.
Come startup di un dispositivo medico è importante sostenere la vostra innovazione scientifica e ingegneristica con l'agilità per muoversi più velocemente orizzontalmente attraverso il processo decisionale normativo e questo potrebbe essere ottenuto avendo punti di controllo strategici in ogni fase del processo di sviluppo del dispositivo medico. Pensate a questo dal punto di vista del ciclo di vita del prodotto, dovrete affrontare sfide ogni volta, dall'inizio dell'idea al lancio sul mercato e dall'approvazione normativa all'adozione sul mercato. Il punto è che le sfide e lo sviluppo dei dispositivi medici sono arrotolati insieme e l'unico modo per srotolarli è tramite lo slancio scientifico/ingegneristico sul lato dello sviluppo e tramite il processo decisionale normativo basato sulla scienza sul lato dell'approvazione.
2. Classificazione dei dispositivi
Dopo l'ideazione del prodotto e la definizione delle caratteristiche, il passo successivo è quello di verificare la classificazione normativa basata sul rischio per il vostro dispositivo. Dovete assicurarvi di identificare il rischio associato al vostro dispositivo e selezionare la classe appropriata in base al mercato normativo in cui scegliete di entrare. In questa fase potresti anche aver bisogno di assicurarti che l'uso previsto del tuo dispositivo sia chiaramente definito. Questo è molto importante e se state pianificando la 510(k) allora assicuratevi che l'uso previsto del vostro dispositivo corrisponda al dispositivo predicato.
A seconda del luogo geografico e normativo in cui intendete applicare il vostro dispositivo medico, sia negli Stati Uniti che nella Commissione europea, potreste aver bisogno di classificare il vostro dispositivo secondo il pannello di classificazione dei dispositivi medici (Classificazione dei dispositivi medici US FDA) o MEDDEV 2.4/1 Rev. 9 (IT orientamento MEDDEV), rispettivamente. Il componente di gran lunga più grande della vostra presentazione sarà coperto dalla sezione di classificazione dei dispositivi medici. Questa sezione definisce i requisiti normativi per il vostro dispositivo. A seconda della classe di dispositivo medico che avete selezionato, è una buona idea controllare i documenti guida esistenti pubblicati dalle autorità di regolamentazione. Per esempio, negli Stati Uniti, la metà delle volte è possibile che la FDA abbia già un documento guida pertinente alla vostra domanda. Tale guida può servire come un riferimento pronto per il ciclo di revisione accelerato e migliori possibilità di approvazione nel vostro primo deposito. Questi documenti guida sono pubblicati per guidare sia le aziende innovatrici di dispositivi medici come la vostra sia i revisori dell'agenzia per una revisione più veloce delle domande. Inoltre, dovete cercare qualsiasi proprietà intellettuale preesistente sull'idea proposta o simile; potrebbe non permettervi di usare il meccanismo o la tecnologia. Per effettuare una fase di scoperta completa, un forte team di sviluppo è cruciale. Questo può essere una trappola se il team non ha una buona esperienza. In ogni caso, si può decidere di andare con un team interno, un consulente o una società di ingegneria di dispositivi medici.
La considerazione chiave per le aziende mentre cercano un consulente interno o esterno consulente per dispositivi medici è che devono avere esperienza nelle seguenti aree:
- Ingegneria e design
- Fattori umani e ingegneria dell'usabilità
- Conoscenza clinica e scientifica del settore medico
- Regulatory affairs and quality assurance
- Diritto della proprietà intellettuale
3. Fase di scoperta
The discovery phase where you will take your idea into the initial designing stage and develop prototypes for your device. This stage involves a lot of brainstorming with engineers, design consultants and your team to make 3D prototypes through simulations and computer-assisted designs and test those prototypes for proof-of-concept. You should also start looking at the FDA guidance documents to find out which critical functionality tests are pertinent to your device and start using them as a decision-matrix for finalizing the ideal design of your device. For the startups which are still boot-strapping for finances, it will be cost-prohibitive to run all the tests as per the guidance documents so I would rather advise to choose one or two most relevant tests and use them for design optimization. Once you have optimized your medical device concept and design, you may now proceed for regulatory approval and commercialization. It is noteworthy here that the US FDA critical path initiative focused on the science of development: better toxicology, biomarcatori, improved studi clinicie la medicina personalizzata, ma questa iniziativa, come altre, tra cui le iniziative di reingegnerizzazione degli anni '90 e i cambiamenti legislativi che hanno accompagnato le tasse d'uso dei dispositivi, non ha esaminato la struttura normativa del processo di approvazione stesso e il modo in cui la struttura normativa determina le scelte nella scienza dello sviluppo.
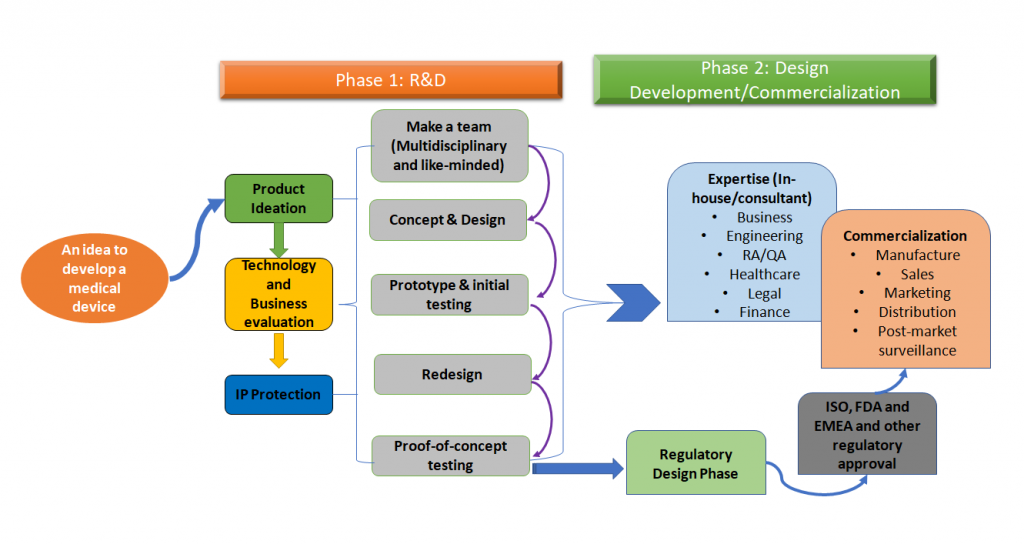
Figura 1: Lo sviluppo di un dispositivo medico è un processo olistico. Questa è una versione semplificata del processo che è un approccio per fasi, ma idealmente, tutti i passi di questo intero processo devono essere tracciati all'inizio durante lo sviluppo del dispositivo medico (adattato da [1,2]).
Hai bisogno di aiuto per sviluppare un dispositivo medico? Sfoglia consulenti di dispositivi medici su Kolabtree. È gratuito contattare un esperto o pubblicare il tuo progetto.
Leggi anche: Quanto costa assumere un consulente di dispositivi medici?
Riferimenti
- https://www.welldoc.com/health-plans/
- https://ec.europa.eu/docsroom/documents/10337/attachments/1/translations
- FDA, 2005, Total Product Lifecycle, FDA-CDRH Presentation by CDRH Director Dr. David Feigal, http://www.fda.gov/cdrh/strategic/presentations/ tplc.html
Tutti gli articoli di questa serie:
Sviluppo e progettazione di dispositivi medici: Una guida definitiva
Sviluppo di dispositivi medici: 3 consigli per il successo
Progettazione di dispositivi medici: L'essenziale, guida passo dopo passo
Commercializzazione dei dispositivi medici: 9 passi dallo schizzo al lancio
Come superare le sfide della commercializzazione dei dispositivi medici
Lancio di un dispositivo medico: Passi chiave per portare il tuo prodotto sul mercato
Sorveglianza post-commercializzazione dei dispositivi medici: Una guida completa







