Shrinidh Joshi, consultant medtech on Kolabtree, provides 3 tips for successful dispositif médical development that will help take your product to market quickly.
When you have an idea (either on a back of a ‘napkin’ or still brainstorming) for the development of a new medical device, it is very much likely that your idea will be disruptive like ‘no other’ and it will have a significant impact on the soins de santé or it is just another way to look at the things. There is also a possibility that your product will help to resolve some of the current challenges for example ‘form factor’ and bulkiness of the spirometer device was a huge challenge until the discovery of portable, hand-held spirometer devices. Similarly, the discovery of blood glucose monitors was transformative like no other for millions of diabetics.
Il n'est pas nécessaire de concevoir un dispositif médical extraordinaire ou perturbateur, un dispositif médical qui peut apporter une valeur ajoutée aux utilisateurs existants a également des chances d'offrir des avantages aux utilisateurs, comme un logiciel en tant que dispositif médical tel que BlueStar. [1] qui aide à gérer le mode de vie et les médicaments des diabétiques. Le plus grand dilemme pour une startup de dispositifs médicaux est de savoir si son dispositif sera en mesure de conquérir une part rentable du marché. La plupart du temps, l'énigme provient soit du contrôle de la qualité ou de la validité du dispositif médical, soit de la complexité de la mise sur le marché d'un dispositif médical. Pour les jeunes entreprises de dispositifs médicaux, je dirais que si vous n'avez pas d'experts pour vous guider tout au long du processus, les deux peuvent faire dérailler votre projet. Dans certains cas, si vous avez conçu un dispositif médical qui a le potentiel de perturber le marché et d'apporter de nouvelles façons d'envisager le traitement, peut-être n'avez-vous pas pensé aux exigences réglementaires que ce type de dispositif pourrait avoir, ou peut-être que les organismes de réglementation ne sont pas en mesure de classer votre dispositif. J'ai été associé à une entreprise qui avait une idée brillante pour combiner un dispositif thérapeutique avec un dispositif de diagnostic afin de fournir des avantages de bout en bout à l'utilisateur final, mais la confusion pour l'organisme de réglementation était d'examiner ce dispositif comme un médicament ou sous 510(k) comme un dispositif de diagnostic. Par conséquent, une approche holistique prenant en compte tous les aspects de la validité de la conception, du contrôle de la qualité et du cadre réglementaire est une approche plus sage que de les aborder au fur et à mesure des besoins. Cela exige de la précision à chaque étape - de l'idéation du produit à sa conception et à son développement, en passant par la conformité, les tests, la mise à l'échelle et la commercialisation du produit.
Dans cet article, nous allons nous pencher sur la phase de conception et de développement du processus de développement des dispositifs médicaux. Cette étape, comme on peut le penser, est la plus importante du cycle de vie d'un dispositif médical. En tant que jeune entreprise de dispositifs médicaux, si vous omettez une étape clé dans la définition ou la conception de votre dispositif médical, vous risquez de ne pas être en conformité avec les organismes de réglementation et votre dispositif ne pourra pas être mis sur le marché. Même si vous réussissez à contourner les obstacles réglementaires pour un dispositif mal défini ou conçu, il risque de ne pas être en mesure de répondre à ses revendications en matière d'utilisation prévue ou d'avantages par rapport à ses prédécesseurs ou concurrents. D'un autre côté, un produit bien défini et conçu a beaucoup de chances de perturber le marché et d'être finalement adopté par celui-ci.
Comme pour tout produit de santé, qu'il s'agisse d'un médicament ou d'un dispositif médical, il faut déployer des efforts considérables et faire preuve d'une grande méticulosité pour fournir la bonne solution qui répondra aux exigences du client. En tant que jeune entreprise de dispositifs médicaux, vous devez vous assurer que toutes les parties prenantes sont en phase avec la portée du produit, les éléments livrables, la définition, les spécifications, la conception, le facteur de forme, la stratégie d'atténuation des risques et les exigences réglementaires. Essentiellement, tous les efforts susmentionnés doivent viser à obtenir la meilleure qualité possible pour votre dispositif médical.
Développement des dispositifs médicaux : Du produit à la phase de découverte
1. Idéation et conceptualisation du produit
The first step in medical device innovation is to analyze and identify the medical device market. As mentioned above, you are analyzing to see if your device is meeting unmet medical needs like early diagnosis of a difficult to cure disease or it is providing a more efficient way to manage a chronic disease. The problem statement for your medical device could be a novel or a better way to monitor adherence to the treatment regimen, monitoring ailment and health, improving drug delivery minimizing the drug requirements and adverse drug events, using intelligence artificielle, apprentissage machine, apprentissage profond, or real-world insights etc. Innovative software can also be defined and approved as a medical device under a software as a medical device (SaMD) category.
Identifier le besoin avec la demande est une étape primordiale pour créer une offre de dispositifs médicaux, en plus d'être prêt pour la conformité. Le succès de cette démarche dépend en grande partie de deux éléments :
- L'écart entre le besoin du marché cible et ce que le développeur de dispositifs médicaux perçoit comme étant le besoin ; moins l'écart est important, meilleures sont les données pour la définition du produit ;
- Une définition solide du produit est extraite de l'analyse des besoins du marché.
Le processus global de développement d'un dispositif médical peut être simplifié selon la figure 1 ci-dessous.
En tant que jeune entreprise de dispositifs médicaux, il est important de soutenir votre innovation scientifique et technique en faisant preuve d'agilité afin d'accélérer le processus de décision réglementaire, ce qui peut être réalisé en mettant en place des points de contrôle stratégiques à chaque étape du processus de développement des dispositifs médicaux. Pensez-y du point de vue du cycle de vie d'un produit, vous serez confronté à des défis à chaque fois, de la naissance de l'idée au lancement sur le marché et de l'approbation réglementaire à l'adoption par le marché. Le fait est que les défis et le développement de dispositifs médicaux sont liés et que le seul moyen de les relever est de donner un élan scientifique et technique au développement et de prendre des décisions réglementaires fondées sur la science pour l'approbation.
2. Classification des dispositifs
Après l'idéation du produit et la définition de ses caractéristiques, l'étape suivante consiste à vérifier la classification réglementaire de votre dispositif en fonction du risque. Vous devez vous assurer d'identifier le risque associé à votre dispositif et sélectionner la classe appropriée en fonction du marché réglementaire dans lequel vous choisissez d'entrer. À ce stade, vous devrez peut-être aussi vous assurer que l'utilisation prévue de votre dispositif est clairement définie. Il s'agit d'un point très important et si vous envisagez d'utiliser la procédure 510(k), assurez-vous que l'utilisation prévue de votre dispositif correspond au dispositif prédicat.
Selon le lieu géographique et réglementaire où vous avez l'intention d'appliquer votre dispositif médical, que ce soit aux États-Unis ou à la Commission européenne, vous pouvez avoir besoin de classifier votre dispositif selon le Medical device classification panel (Classification des dispositifs médicaux de la FDA américaine) ou MEDDEV 2.4/1 Rev. 9 (EN guidance MEDDEV), respectivement. La section relative à la classification des dispositifs médicaux est de loin la plus importante composante de votre demande. Cette section définit les exigences réglementaires pour votre dispositif. En fonction de la classe de dispositif médical que vous avez choisie, il est bon de vérifier les documents d'orientation existants publiés par les autorités réglementaires. Par exemple, aux États-Unis, la moitié du temps, il est possible que la FDA ait déjà publié un document d'orientation relatif à votre application. Ces documents d'orientation peuvent servir de référence pour le cycle d'examen accéléré et améliorer les chances d'approbation de votre première demande. Ces documents d'orientation sont publiés pour guider à la fois les entreprises innovantes de dispositifs médicaux comme la vôtre et les examinateurs de l'agence pour un examen plus rapide des demandes. Vous devez également rechercher toute propriété intellectuelle préexistante sur l'idée proposée ou similaire ; elle pourrait vous interdire d'utiliser le mécanisme ou la technologie. Pour mener à bien une phase de découverte complète, il est essentiel de disposer d'une équipe de développement solide. Cela peut être un écueil si l'équipe n'est pas très expérimentée. Dans tous les cas, vous pouvez décider de faire appel à une équipe interne, à un consultant ou à une société d'ingénierie de dispositifs médicaux.
La considération clé pour les entreprises qui recherchent un consultant interne ou externe est la suivante consultant en dispositifs médicaux est qu'ils doivent avoir une expertise dans les domaines suivants :
- Ingénierie et conception
- Facteurs humains et ingénierie de l'utilisabilité
- Connaissance clinique et scientifique de l'industrie médicale
- Regulatory affairs and quality assurance
- Droit de la propriété intellectuelle
3. Phase de découverte
The discovery phase where you will take your idea into the initial designing stage and develop prototypes for your device. This stage involves a lot of brainstorming with engineers, design consultants and your team to make 3D prototypes through simulations and computer-assisted designs and test those prototypes for proof-of-concept. You should also start looking at the FDA guidance documents to find out which critical functionality tests are pertinent to your device and start using them as a decision-matrix for finalizing the ideal design of your device. For the startups which are still boot-strapping for finances, it will be cost-prohibitive to run all the tests as per the guidance documents so I would rather advise to choose one or two most relevant tests and use them for design optimization. Once you have optimized your medical device concept and design, you may now proceed for regulatory approval and commercialization. It is noteworthy here that the US FDA critical path initiative focused on the science of development: better toxicology, biomarqueurs, improved les essais cliniques, and personalized medicine, but that initiative, like others including the re-engineering initiatives of the 1990s and legislative changes that accompanied device user fees, did not examine the regulatory structure of the approval process itself and how the regulatory structure determines the choices in the science of development.
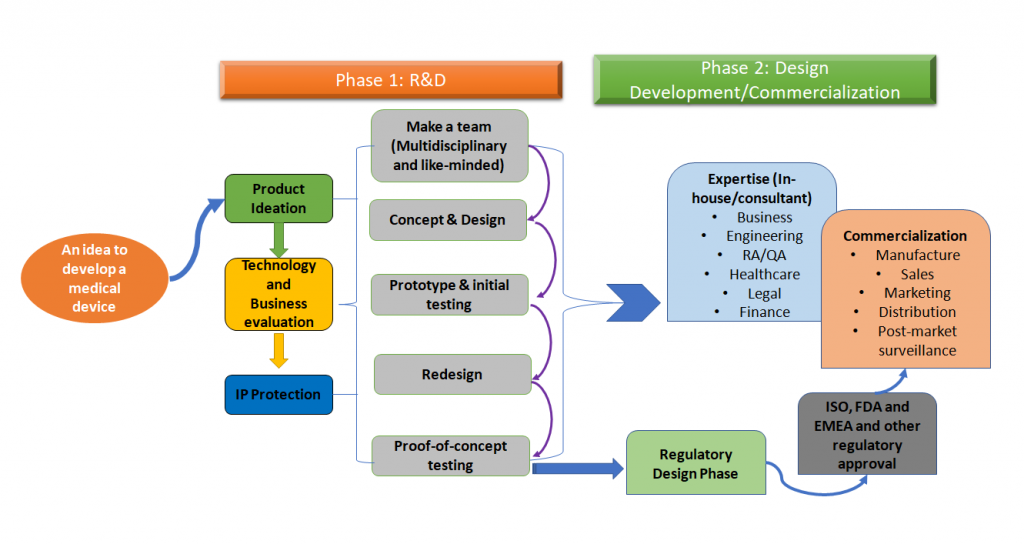
Figure 1 : Le développement de dispositifs médicaux est un processus holistique. Il s'agit d'une version simplifiée du processus, qui est une approche par phase, mais idéalement, toutes les étapes de ce processus doivent être définies dès le début du développement du dispositif médical. [1,2]).
Vous avez besoin d'aide pour développer un dispositif médical ? Parcourir consultants en dispositifs médicaux sur Kolabtree. C'est gratuit de contacter un expert ou de poster votre projet.
Lisez aussi : Combien coûte l'embauche d'un consultant en dispositifs médicaux ?
Références
- https://www.welldoc.com/health-plans/
- https://ec.europa.eu/docsroom/documents/10337/attachments/1/translations
- FDA, 2005, Total Product Lifecycle, FDA-CDRH Presentation by CDRH Director Dr. David Feigal, http://www.fda.gov/cdrh/strategic/presentations/ tplc.html
Tous les articles de cette série :
Développement et conception de dispositifs médicaux : Un guide définitif
Développement de dispositifs médicaux : 3 conseils pour réussir
Medical Device Design : Le guide essentiel, étape par étape
Commercialisation des dispositifs médicaux : 9 étapes de l'esquisse au lancement
Comment surmonter les défis de la commercialisation des dispositifs médicaux
Lancement de dispositifs médicaux : Étapes clés pour mettre votre produit sur le marché
Surveillance post-commercialisation des dispositifs médicaux : Un guide complet







