Kolabtree freelance biostatistician consultant, Rudra Patel provides a comprehensive guide on how to develop a Statistical Analysis Plan (SAP) for Essais cliniques.
1. Plan d'analyse statistique (PAS) dans un essai clinique (EC)
Il est important de disposer d'un plan d'analyse statistique (PAS) complet et bien rédigé afin d'augmenter la probabilité de réussite de l'étude. la qualité des essais cliniques et la rendre plus valide et généralisée.
SAP is a defined outline of the planned statistical basic/advance methods for the analyses for a clinical trial and is written in study protocol as well as separately. SAP is crucial and is one of the key Regulatory confidential documents in the development of a clinical trial. An SAP is a more challenging task in a clinical trial protocol development that requires a strong command on statistical methodology, medical terminology and visualization power. It provides explicit guidance on statistical programming and the presentation of results for clinical trial. The following four important types of SAP are used in a clinical trial (Figure 1).
- Suivi des données
- Analyse statistique intermédiaire
- Plan d'analyse statistique intégré
- Plan d'analyse statistique pour l'étude clinique
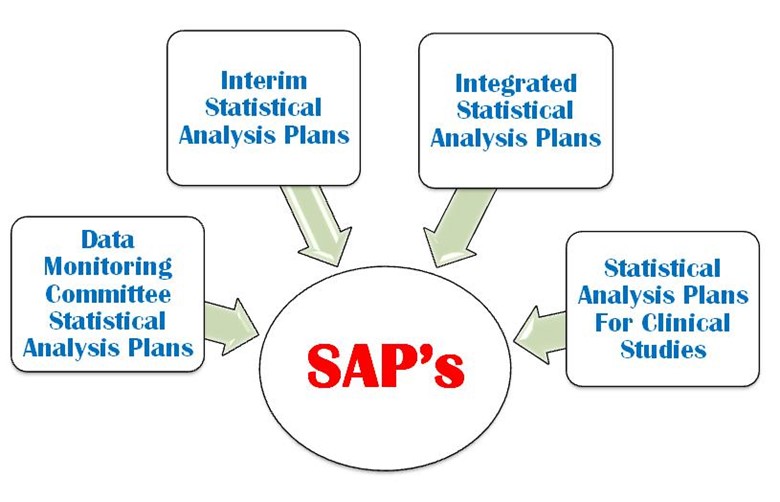
Figure 1 : Quatre types importants de SAP sont utilisés dans un CT
The SAP is mostly written as a separate document or it is included in CT study protocol as a standard operating procedure for dealing with the statistical part of the clinical study. A team statisticien médical/biostatistician is in-charge of developing the SAP in coordination with the principal investigator of the CT study. The document should be reviewed by Senior Biostatistician and finalized before to submission to the review board and regulatory authorities. If any protocol amendments are done, then the SAP is amended as well.
The SAP must properly explain following the aims and primary objectives, secondary objective, exploratory objectives, primary/secondary/exploratory endpoints, trial population, design of the trial, sample size calculations with justifications/assumptions, and the randomization methods. Additionally, an SAP must describe in detail the statistical methodology i.e. efficacy analysis, safety analyse des données, reporting conventions, etc. Figure 2 shows the most important points that need to be considering when developing SAP in the clinical trial study protocol.
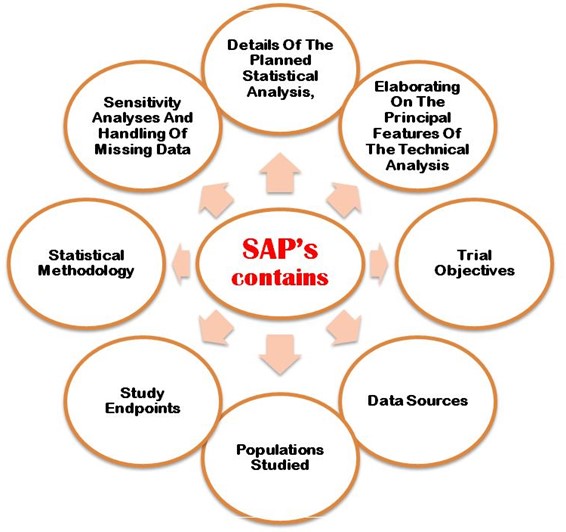
Figure 2 : Détail des points importants à prendre en compte lors du développement du SAP dans le protocole CT.
Le plan d'analyse élaboré doit être examiné avec une attention particulière et approuvé par un biostatisticien senior en aveugle avant le verrouillage de la base de données par les autorités. Ahrweiler et al. 2011 Le document de conférence publié en ligne explique l'importance de l'examen du plan d'analyse statistique. Les points importants à prendre en compte lors de l'élaboration d'un plan d'analyse statistique dans un protocole de tomographie par ordinateur sont détaillés ci-dessous,
- Détail de l'analyse statistique prévue
- Elaborer les principales caractéristiques de l'analyse technique.
- Objectifs de l'essai
- Sources de données
- Population étudiée
- Paramètres de l'étude
- Méthodologie statistique
- Analyse de sensibilité et données manquantes
Le SAP de l'essai clinique doit être élaboré à la suite d'une discussion approfondie entre les principaux investigateurs de l'étude et le statisticien. Voici le rôle et la responsabilité du statisticien,
- Pour écrire un recherche statement or hypothesis of the clinical trial study.
- Déterminez les paramètres primaires et secondaires.
- Trouver et développer une stratégie pour réduire le biais et la sélection de la taille de l'échantillon pour les essais cliniques.
- Définir toutes les méthodes statistiques appropriées pour l'analyse des données des essais cliniques.
Dans le développement de SAP dans l'essai clinique besoin d'expliquer en profondeur les points saillants clés. Yuan et al.2019 ont publié un article d'intérêt spécial sur "Guide du plan d'analyse statistique" [Figure 2]. L'article présente en profondeur le SAP d'une étude de recherche d'essai clinique réelle afin de fournir un guide pratique détaillé sur la rédaction d'un SAP efficace. En outre, dans le même article, il est question du quoi, du pourquoi d'un PAS, du quand et du qui, ainsi que des principaux contenus du PAS. La nécessité pour les études de recherche sur les essais cliniques d'avoir des PAS bien écrits et documentés, en particulier pour les études réglementaires.
2. Importance du plan d'analyse statistique dans les essais cliniques
Le CT est réalisé sur tous les nouveaux processus de développement de médicaments et de dispositifs médicaux. Depuis une dizaine d'années, les patients recrutés dans les essais cliniques pour le développement de médicaments proviennent de plus en plus souvent d'Europe, des États-Unis et de pays en développement.
Dans les études cliniques, le PAS est l'un des documents les plus importants. Il garantit que les analyses visant à évaluer toutes les hypothèses de l'étude planifiée au préalable sont menées d'une manière scientifiquement valide et que toutes les décisions sont documentées. Il fournit également des détails approfondis sur la manière dont les résultats seront présentés et rapportés dans le cadre de la CT.
Les essais cliniques sont utilisés pour évaluer les avantages supplémentaires et améliorer les interventions dans le domaine médical. soins de santé. The more important thing to consider while conducting a clinical trial is to execute the trial with minimum bias. Therefore, each clinical trial to have a clear and detailed SAP to its support to reproducibility. For the best practice of CT scientific research studies, reproducibility of research, and to avoid concerns of misuse of clinical research, a clear detailed and very transparent SAP much be needed, to improve trial conduct and reporting. Following are three essential roles of SAP needs to maintain in conducting CT.
- La transparence : Transparence concernant la manière dont l'analyse se déroulera en spécifiant à l'avance la méthodologie qui sera appliquée
- La communication : Une communication claire à toutes les personnes impliquées dans l'étude sur la manière de procéder.
- Reproduction : Facilite la réplication, de sorte qu'une future équipe de recherche puisse suivre les mêmes étapes pour confirmer les résultats sur le même échantillon ou sur un nouvel échantillon.
Conformément aux directives standard et aux meilleures pratiques, il est important que le statisticien/biostatisticien du projet d'essai clinique prépare un SAP d'étude avant le début de l'essai clinique, détaillant toutes les analyses prévues, les paramètres de l'étude, y compris les définitions des ensembles d'analyse et la méthodologie statistique de base/avancée.
En outre, d'autres considérations importantes relatives au SAP en CT comprennent :
- Une façon de minimiser le biais est de rendre le biostatisticien aveugle.
- Le SAP doit être documenté de manière à ce que toutes les manipulations de données et les analyses effectuées puissent être reproduites.
- Un dossier principal de l'essai doit être tenu à jour par le biostatisticien avec toute la documentation pertinente à la fin de l'essai.
Le plan d'analyse organisé de manière systématique aide l'équipe de l'essai clinique à être ensemble sur la même page et ajoute une autre couche de spécificité à l'EC. Il décrit la méthodologie statistique systématique planifiée d'une étude de recherche d'essai clinique. Par rapport au protocole de l'essai clinique, le SAP est un document technique approfondi dans lequel sont détaillées les techniques statistiques pour la conception de l'étude et l'analyse des données des essais cliniques. Lors de la rédaction du SAP, nous suivons généralement les directives ICH E3 et E9. Cela nous donne une idée du contenu des différentes sections du SAP. Mais E3 et E9 ne spécifient pas de techniques statistiques spécifiques.
Améliorer la reproductibilité, la transparence et la validité des essais cliniques. Instituts nationaux de la santé (NIH) a publié des "Règles pour l'enregistrement des études d'essais cliniques et la soumission des informations sur les résultats", qui rendent obligatoire l'enregistrement des essais, la publication du recrutement en cours ou des résultats des essais cliniques sur ClinicalTrials.gov, et la soumission du document original distinct, le plan d'analyse statistique (PAS), avec le protocole de recherche de l'essai clinique.
La grande contribution du statisticien/biostatisticien médical, outre le développement d'un SAP standard, est la conception, le suivi et l'analyse des données des essais cliniques.
3. Liste de contrôle/directives détaillées pour les PAS dans les essais cliniques
Lors de l'élaboration du protocole d'essai de tomodensitométrie, nous devons prendre en considération toutes les listes de contrôle détaillées et les directives standard. Les directives importantes utilisées dans le développement du PAS sont ICH E9 (Conférence internationale pour l'harmonisation des exigences techniques relatives aux produits pharmaceutiques à usage humain) et SPIRIT (Standard Protocol Items : Recommendations for Interventional Trials).
La transparence et la reproductibilité sont des termes fondamentaux qui ajoutent de la valeur aux données des essais cliniques. Cependant, l'influence de la méthodologie statistique affecte directement la prise de décision dans les essais cliniques. Une conduite statistique bien documentée, confidentielle et transparente est essentielle. Des statisticiens médicaux/biostatisticiens experts peuvent aider à développer des PAS conformément aux directives standard.
Conformément à la directive ICH E9, les PAS, généralement connus sous le nom de plans de rapport et d'analyse, peuvent également être appelés plans d'analyse des données (DAP) ou plans d'analyse statistique (PAS) dans d'autres organisations. Les directives de l'ICH E9 stipulent que "les principales caractéristiques de l'éventuel PAS des données doivent être décrites dans la section statistique du protocole". Cependant, les directives SPIRIT (Standard Protocol Items : Recommendations for Interventional Trials) font référence à un PAS distinct.
Le SAP est un document essentiel en matière de CT qui doit faire l'objet d'un rapport aux autorités réglementaires (par exemple, la Food and Drug Administration (FDA), l'Agence européenne des médicaments (EMA)). Les directives standard suggèrent que le SAP doit être stocké dans le fichier maître confidentiel de l'essai clinique et il est utilisé pendant les audits des autorités réglementaires pour vérifier si les documents statistiques suivent exactement les directives standard.
Le SAP est le document le plus couramment utilisé pour guider les statisticiens. En général, les éléments suivants doivent être inclus dans un PAS (Figure 3).
Il faut s'adresser au statisticien Le site Déclaration de CONSORT (et toute extension) et aussi ICH E9 Principes statistiques pour les essais cliniques (PDF, 325 KB).
- Station de planification et de conception des essais
- Le réseau EQUATOR- Un centre de ressources pour la rédaction de bons rapports sur les études de recherche dans le domaine de la santé.
- Le site web du CONSORT
- En 2017, les lignes directrices publiées par Gamble et al.2017, les lignes directrices de ces articles recommandent un minimum de 55 éléments importants à prendre en compte lors de l'élaboration d'un suivi SAP.
- Titre et enregistrement
- Introduction
- Méthodes d'étude
- Principes statistiques
- Population de l'essai
- Analyse
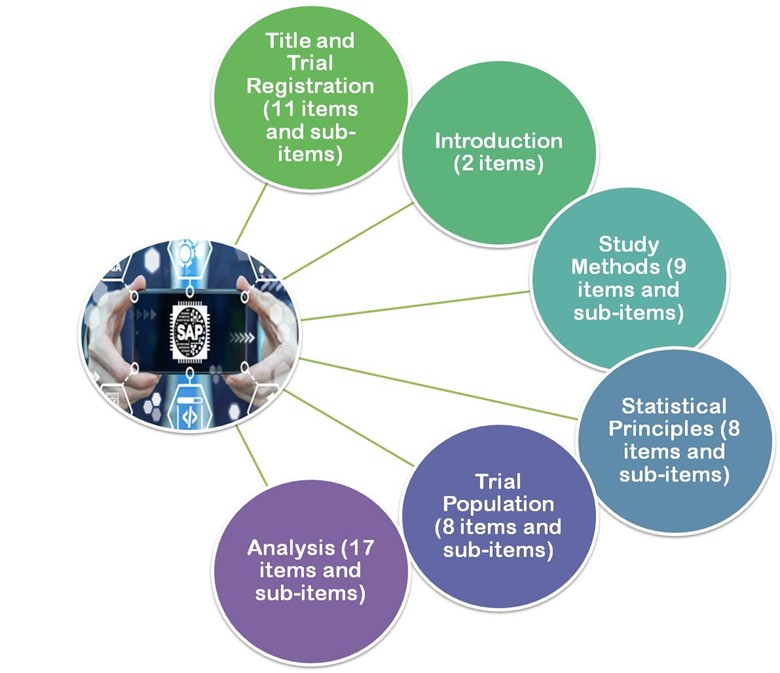
Figure 3 : Gamble et al. 2017, les lignes directrices sont divisées en 6 grandes sections.
4. En quoi consiste un SAP ?
A liste de contrôle de 32 listes de contrôle détaillées pour l'élaboration du Liste de contrôle du plan d'analyse statistique (PAS) (Word). L'intention première est d'être plus applicable aux analyses finales des TC ainsi qu'aux TC randomisés en phase ultérieure. Les directives les plus importantes élaborées par la FDA sont les suivantes Guide pour l'industrie : Principes statistiques pour les essais cliniques.
Les directives et recommandations suivantes concernant le contenu d'un SAP :
- Le SAP n'est pas un document autonome et doit être lu conjointement avec le protocole de l'essai clinique.
- Le protocole de l'essai clinique doit être conforme aux principes du Déclaration SPIRIT 2013.
- Le SAP doit être appliqué à un ensemble de données propres ou validées pour l'analyse.
Des lignes directrices détaillées élaborées par des bailleurs de fonds, des autorités réglementaires, des revues, des représentants de l'industrie et Unités d'essais cliniques enregistrées auprès de la UK Clinical Research Collaboration (UKCRC CTUs). Les lignes directrices pour le contenu des plans d'analyse statistique dans les essais cliniques décrivent en détail les éléments suivants JAMA. Toutefois, une explication plus approfondie de chaque liste de contrôle par point peut être trouvée dans le document document d'élaboration. La déclaration SAP également incluse est incluse dans le Réseau Equateur et Partenariat MRC-NIHR de recherche sur la méthodologie des essais (TMRP). Voici les principaux documents et les liens clés utilisés pour développer le PAS dans les essais cliniques (Figure 4).
- Document clé
- Liste de contrôle
- Élaboration
- Article du JAMA
- Liens clés
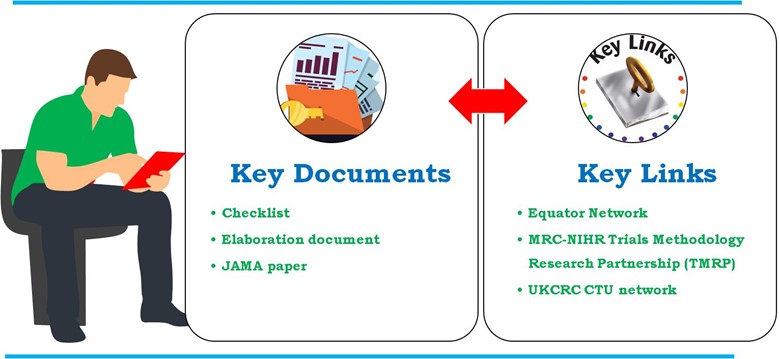
Figure 4 : Documents et liens clés utilisés pour développer le SAP dans les essais cliniques
5. Embauche d'un statisticien clinique indépendant pour l'aider avec les PAS
Le développement d'un PAS nécessite souvent le soutien d'un statisticien clinique indépendant. Avec l'aide d'un biostatisticien expérimenté, vous pouvez développer un SAP complet et sans erreur, qui améliorera la qualité de vos essais cliniques.
Parcourir consultants en essais cliniques sur Kolabtree maintenant et entrez directement en contact avec un expert.







