Kolabtree freelance biostatistician consultant, Rudra Patel provides a comprehensive guide on how to develop a Statistical Analysis Plan (SAP) for Ensayos clínicos.
1. Plan de análisis estadístico (SAP) en un ensayo clínico (CT)
Un Plan de Análisis Estadístico (PAE) bien redactado y completo es importante para aumentar la calidad de los ensayos clínicos y hacerla más válida y generalizada.
SAP is a defined outline of the planned statistical basic/advance methods for the analyses for a clinical trial and is written in study protocol as well as separately. SAP is crucial and is one of the key Regulatory confidential documents in the development of a clinical trial. An SAP is a more challenging task in a clinical trial protocol development that requires a strong command on statistical methodology, medical terminology and visualization power. It provides explicit guidance on statistical programming and the presentation of results for clinical trial. The following four important types of SAP are used in a clinical trial (Figure 1).
- Control de datos
- Análisis estadístico provisional
- Plan de análisis estadístico integrado
- Plan de análisis estadístico para el estudio clínico
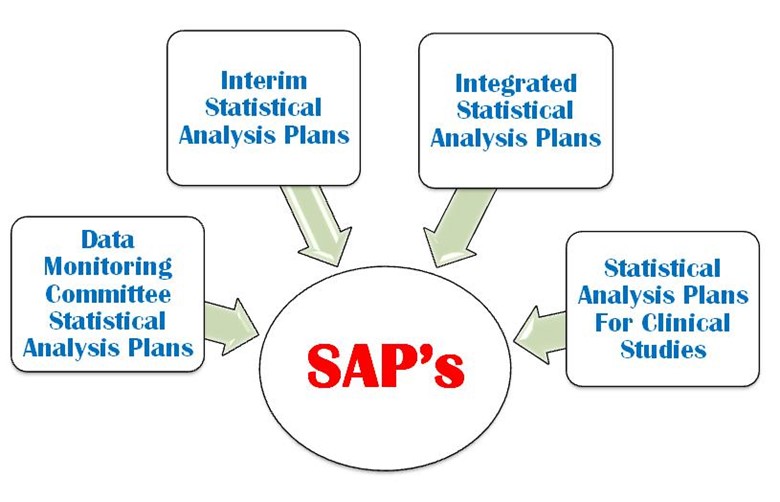
Figura 1: Cuatro tipos importantes de SAP se utilizan en un TC
The SAP is mostly written as a separate document or it is included in CT study protocol as a standard operating procedure for dealing with the statistical part of the clinical study. A team estadístico médico/biostatistician is in-charge of developing the SAP in coordination with the principal investigator of the CT study. The document should be reviewed by Senior Biostatistician and finalized before to submission to the review board and regulatory authorities. If any protocol amendments are done, then the SAP is amended as well.
The SAP must properly explain following the aims and primary objectives, secondary objective, exploratory objectives, primary/secondary/exploratory endpoints, trial population, design of the trial, sample size calculations with justifications/assumptions, and the randomization methods. Additionally, an SAP must describe in detail the statistical methodology i.e. efficacy analysis, safety análisis de datos, reporting conventions, etc. Figure 2 shows the most important points that need to be considering when developing SAP in the clinical trial study protocol.
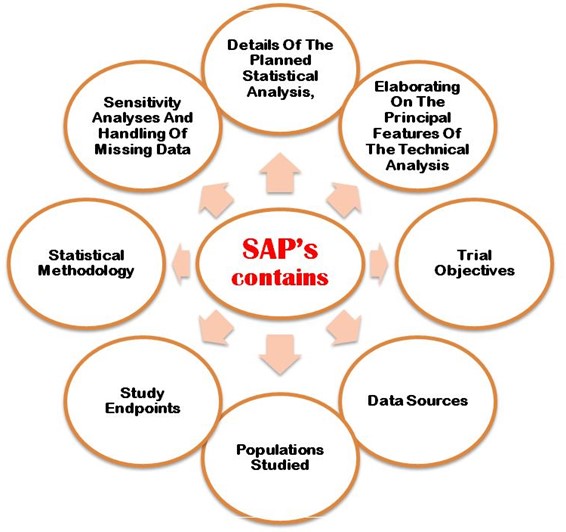
Figura 2: Detalle de los puntos importantes a tener en cuenta en el desarrollo del protocolo SAP en CT.
El plan de análisis desarrollado debe ser revisado con especial atención y aprobado por un bioestadístico ciego de alto nivel antes del bloqueo de la base de datos por parte de las autoridades. Ahrweiler et al. 2011 El documento de la conferencia publicado en línea explica la importancia del plan de análisis estadístico de revisión. A continuación se detallan los puntos importantes que se deben tener en cuenta a la hora de elaborar el protocolo de análisis estadístico en la TC,
- Detalle del análisis estadístico previsto
- Elaborar las principales características del análisis técnico.
- Objetivos del ensayo
- Fuentes de datos
- Población estudiada
- Puntos finales del estudio
- Metodología estadística
- Análisis de sensibilidad y datos que faltan
El SAP del ensayo clínico debe desarrollarse con una discusión en profundidad entre los investigadores principales del estudio y el estadístico. A continuación se describen las funciones y responsabilidades del estadístico,
- Para escribir un investigación statement or hypothesis of the clinical trial study.
- Determinar los criterios de valoración primarios y secundarios.
- Averiguar y desarrollar una estrategia para reducir el sesgo y la selección del tamaño de la muestra para el ensayo clínico
- Definir todos los métodos estadísticos apropiados para el análisis de los datos de los ensayos clínicos
En el desarrollo de SAP en el ensayo clínico necesidad de explicar en profundidad los puntos destacados clave. Yuan et al.2019 publicó un artículo de interés especial sobre "Guía del plan de análisis estadístico" [Figura 2]. El artículo profundiza en el SAP de un estudio de investigación de un ensayo clínico real para proporcionar una guía práctica detallada sobre la redacción de un SAP eficaz. Además, en el mismo artículo se discute dónde, qué, por qué de un SAP, cuándo y quién, y se destacan los contenidos clave del SAP. La necesidad de que el estudio de investigación de un ensayo clínico esté bien escrito y documentado en los SAP, en particular para los estudios reglamentarios.
2. Importancia del plan de análisis estadístico en los ensayos clínicos
Los ensayos clínicos se realizan en todos los procesos de desarrollo de nuevos fármacos/medicamentos y dispositivos médicos. Desde la última década, la tasa de pacientes reclutados en ensayos clínicos para el desarrollo de fármacos/medicamentos ha aumentado en Europa y Estados Unidos, así como en los países en desarrollo.
En los estudios clínicos, el SAP es uno de los documentos más importantes. Garantiza que los análisis para evaluar todas las hipótesis del estudio previamente planificadas se realicen de forma científicamente válida y que todas las decisiones queden documentadas. También proporciona detalles en profundidad sobre cómo se presentarán y comunicarán los resultados en el TC.
Los ensayos clínicos se utilizan para evaluar los beneficios adicionales y mejorar las intervenciones en la medicina atención de la salud. The more important thing to consider while conducting a clinical trial is to execute the trial with minimum bias. Therefore, each clinical trial to have a clear and detailed SAP to its support to reproducibility. For the best practice of CT scientific research studies, reproducibility of research, and to avoid concerns of misuse of clinical research, a clear detailed and very transparent SAP much be needed, to improve trial conduct and reporting. Following are three essential roles of SAP needs to maintain in conducting CT.
- Transparencia: Transparencia en cuanto a la forma en que se realizará el análisis, especificando con antelación la metodología que se aplicará
- Comunicación: Comunicación clara a todos los implicados en el estudio sobre cómo proceder
- Replicación: Facilita la replicación para que un futuro equipo de investigación pueda seguir los mismos pasos para confirmar los resultados en la misma o en una nueva muestra.
Según las directrices estándar con las mejores prácticas, es importante que el estadístico/bioestadístico del proyecto de ensayo clínico prepare un SAP del estudio antes del inicio del ensayo clínico, detallando todos los análisis planificados, los parámetros del estudio, incluyendo las definiciones del conjunto de análisis y la metodología estadística básica/avanzada.
Además, algunas otras consideraciones importantes relacionadas con el SAP en CT incluyen:
- Una forma de minimizar el sesgo es cegar al bioestadístico.
- El SAP debe estar documentado de forma que todas las manipulaciones de datos y los análisis realizados puedan reproducirse.
- El bioestadístico debe mantener un archivo maestro del ensayo con toda la documentación pertinente al finalizar el ensayo.
El plan de análisis sistemático ayuda al equipo del ensayo clínico a estar juntos en la misma página y añade otra capa de especificidad al TC. Describe la metodología estadística sistemáticamente planificada de un estudio de investigación de un ensayo clínico. En comparación con el protocolo del ensayo clínico, el PAE es un documento técnico en profundidad en el que se detallan las técnicas estadísticas para el diseño del estudio y el análisis de los datos de los ensayos clínicos. Al redactar el SAP, generalmente seguimos las directrices ICH E3 y E9. Esto nos da una idea del contenido del cuerpo de las secciones individuales del SAP. Pero E3 y E9 no especifican técnicas estadísticas específicas.
Mejorar la reproducibilidad, la transparencia y la validez de los ensayos clínicos. Institutos Nacionales de Salud (NIH) publicó las "Normas para el registro de estudios de ensayos clínicos y la presentación de información sobre los resultados", en las que se ordena el registro del ensayo, la publicación del reclutamiento en curso o de los resultados del ensayo clínico en ClinicalTrials.gov , y la presentación del documento original separado del plan de análisis estadístico (SAP) junto con el protocolo del estudio de investigación del ensayo clínico.
La gran contribución del estadístico médico/bioestadístico, además de desarrollar un SAP estándar, es el diseño, el seguimiento y el análisis de los datos de los ensayos clínicos.
3. Lista de comprobación/directrices detalladas para los PAS en los ensayos clínicos
En el desarrollo de SAP de TC, debemos tener en cuenta todas las listas de comprobación detalladas/directrices estándar. Las directrices importantes utilizadas en el desarrollo de SAP son la ICH E9 (Conferencia Internacional para la Armonización de los Requisitos Técnicos para Productos Farmacéuticos de Uso Humano) y SPIRIT (Elementos de Protocolo Estándar: Recomendaciones para Ensayos de Intervención).
La transparencia y la reproducibilidad han sido un término fundamental que añade valor a los datos de los ensayos clínicos. Sin embargo, la influencia de la metodología estadística afecta directamente a la toma de decisiones del ensayo clínico, por lo que es esencial una conducta estadística bien documentada, confidencial y transparente. Los estadísticos médicos/bioestadísticos expertos pueden ayudar a desarrollar los SAP de acuerdo con las directrices estándar.
De acuerdo con la norma ICH E9, los SAP, normalmente conocidos como planes de información y análisis, también pueden denominarse planes de análisis de datos (DAP) o planes de análisis estadístico (SAP) en otras organizaciones. Las directrices de la ICH E9 establecen que "las principales características del eventual SAP de los datos deben describirse en la sección estadística del protocolo". Sin embargo, las directrices SPIRIT (Standard Protocol Items: Recommendations for Interventional Trials) hacen referencia a un SAP separado.
El SAP es un documento esencial en la TC que necesita informar a las autoridades reguladoras (por ejemplo, la Administración de Alimentos y Medicamentos (FDA), la Agencia Europea de Medicamentos (EMA)). Las directrices estándar sugieren que el SAP debe almacenarse en el archivo maestro confidencial del ensayo clínico y se utiliza durante las auditorías de autorización reglamentaria para comprobar si los documentos estadísticos siguen exactamente las directrices estándar.
El SAP es el documento más utilizado para guiar a los estadísticos. En general, en un SAP deben incluirse los siguientes elementos (Figura 3).
Hay que remitir al estadístico El Declaración CONSORT (y cualquier extensión) y también ICH E9 Principios estadísticos para ensayos clínicos (PDF, 325 KB).
- Estación de planificación y diseño de ensayos
- EQUATOR Network- Un centro de recursos para la buena comunicación de los estudios de investigación sanitaria.
- El sitio web de CONSORT
- En 2017 las directrices publicadas por Gamble y otros.2017, las directrices de estos artículos recomiendan un mínimo de 55 elementos importantes que deben tenerse en cuenta a la hora de desarrollar un SAP siguiente.
- Título y registro
- Introducción
- Métodos de estudio
- Principios estadísticos
- Población del ensayo
- Análisis
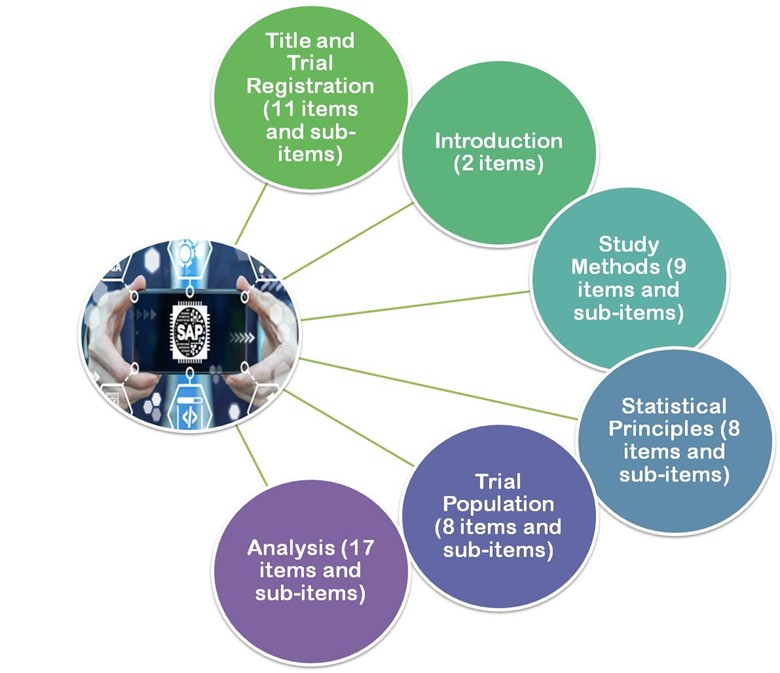
Figura 3: Gamble y otros. 2017, las directrices se dividen en 6 secciones principales.
4. ¿En qué consiste un SAP?
A lista de control de 32 listas de control detalladas para desarrollar el Lista de comprobación del plan de análisis estadístico (SAP) (Word). La intención principal de ser más aplicable a los análisis finales de los TC, así como a los TC aleatorios de fase posterior. Las directrices más importantes desarrolladas por el Guía para la industria: Principios estadísticos para los ensayos clínicos.
Las siguientes directrices y recomendaciones para el contenido de un SAP:
- El SAP no es un documento independiente y debe leerse junto con el protocolo del ensayo clínico.
- El protocolo del ensayo clínico debe ser coherente con los principios de la Declaración SPIRIT 2013.
- El SAP debe aplicarse a un conjunto de datos limpios o validados para su análisis.
Directrices detalladas desarrolladas a través de financiadores, autoridades reguladoras, revistas, representantes de la industria y Unidades de ensayos clínicos registradas por la UK Clinical Research Collaboration (UKCRC CTUs). Las Directrices sobre el contenido de los planes de análisis estadístico en los ensayos clínicos describen en profundidad en JAMA. Sin embargo, se puede encontrar una explicación más detallada de cada lista de control por punto en el documento de elaboración. La declaración del SAP también se incluye en el Red Ecuatorial y MRC-NIHR Trials Methodology Research Partnership (TMRP). A continuación se presentan los documentos y enlaces clave utilizados en el desarrollo del SAP en el ensayo clínico (Figura 4).
- Documento clave
- Lista de control
- Elaboración
- Artículo de JAMA
- Enlaces clave
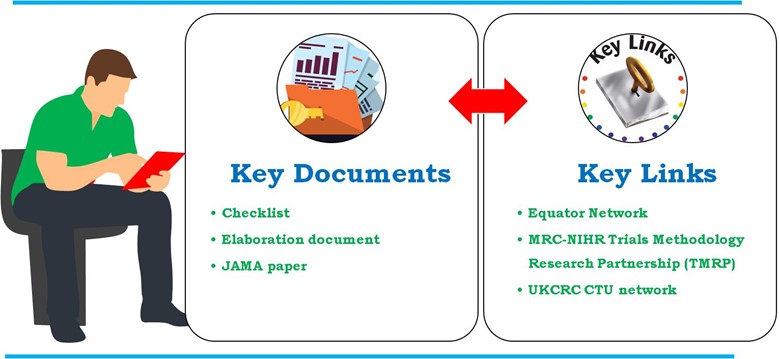
Figura 4: Documentos y enlaces clave utilizados en el desarrollo del SAP en el ensayo clínico
5. Contratación de un estadístico clínico autónomo para que le ayude con los PAE
El desarrollo de un SAP suele requerir el apoyo de un estadístico clínico independiente. Con la ayuda de un bioestadístico experimentado, podrá desarrollar un SAP exhaustivo y sin errores, que mejorará la calidad de sus ensayos clínicos.
Navegue por consultores de ensayos clínicos en Kolabtree ahora y ponte en contacto directamente con un experto.







