Shrinidh Joshi, consultor de tecnología médica on Kolabtree, provides 3 tips for successful dispositivo médico desarrollo que ayudará a llevar su producto al mercado rápidamente.
When you have an idea (either on a back of a ‘napkin’ or still brainstorming) for the development of a new medical device, it is very much likely that your idea will be disruptive like ‘no other’ and it will have a significant impact on the salud or it is just another way to look at the things. There is also a possibility that your product will help to resolve some of the current challenges for example ‘form factor’ and bulkiness of the spirometer device was a huge challenge until the discovery of portable, hand-held spirometer devices. Similarly, the discovery of blood glucose monitors was transformative like no other for millions of diabetics.
No es necesario diseñar un dispositivo médico que sea extraordinario o disruptivo, un dispositivo médico que pueda añadir valor a los usuarios existentes también tiene las posibilidades de proporcionar beneficios al usuario como el software como dispositivo médico como BlueStar [1] which helps in lifestyle and medication management for diabetics. The biggest dilemma for a medical device startup is whether their device will be able to capture a profitable share in the market. Most of the time the conundrum stems either from the quality control or the validity of the medical device or from the complexity of bringing a medical device to the market. For the medical device startups, I would say without having experts to guide you throughout the process both of them can lead to derailment of your project. In some cases, if you have designed a medical device that holds the potential to disrupt the market and bring in new ways of looking at the treatment, maybe you haven’t thought about the regulatory requirements that kind of device might have, or maybe regulatory agencies are not able to classify your device. I was partnered with a company that had a brilliant idea to combine a therapeutic device with a diagnostic device to provide end-to-end benefits to the end-user, however, the confusion for the regulatory agency was to review that device as a drug or under 510(k) as a diagnostic device. Therefore, a holistic approach considering all the aspects of design validity, quality control, and regulatory framework is a wiser approach rather than tackling them as and when needed. It requires precision in every stage — right from product ideation to design and development, compliance, testing, scale-up, and marketing of the product.
En este artículo, echaremos un vistazo a la fase de diseño y desarrollo del proceso de desarrollo de dispositivos médicos. Este paso, como se puede pensar, es la fase más importante del ciclo de vida del producto sanitario. Como empresa nueva de productos sanitarios, si se omite algún paso clave en la definición o el diseño de su producto sanitario, se corre el riesgo de no cumplir con las agencias reguladoras y su producto no podrá llegar al mercado. Aunque consiga sortear los obstáculos reglamentarios con un producto mal definido o diseñado, es posible que al final no consiga cumplir con las afirmaciones sobre el uso previsto o los beneficios sobre sus predecesores o competidores. Por otro lado, un producto bien definido y diseñado tiene mucho potencial para sus pretensiones de disrupción en el mercado y su eventual adopción por parte del mercado.
Como ocurre con todos los productos sanitarios, ya sean fármacos o dispositivos médicos, se requiere una cantidad considerable de esfuerzo y meticulosidad para ofrecer la solución adecuada que pueda satisfacer las demandas de los clientes. Como empresa de dispositivos médicos, hay que asegurarse de que todas las partes interesadas estén alineadas con el alcance del producto, los resultados, la definición, la especificación, el diseño y el factor de forma, la estrategia de mitigación de riesgos y los requisitos reglamentarios. Esencialmente, todos los esfuerzos anteriores deben conducir a la mejor calidad posible para su dispositivo médico.
Desarrollo de dispositivos médicos: De la fase de producto a la de descubrimiento
1. Ideación y conceptualización del producto
The first step in medical device innovation is to analyze and identify the medical device market. As mentioned above, you are analyzing to see if your device is meeting unmet medical needs like early diagnosis of a difficult to cure disease or it is providing a more efficient way to manage a chronic disease. The problem statement for your medical device could be a novel or a better way to monitor adherence to the treatment regimen, monitoring ailment and health, improving drug delivery minimizing the drug requirements and adverse drug events, using inteligencia artificial, aprendizaje automático, aprendizaje profundo, or real-world insights etc. Innovative software can also be defined and approved as a medical device under a software as a medical device (SaMD) category.
Identificar la necesidad con la demanda es un paso primordial para crear una oferta de productos sanitarios, además de estar preparados para el cumplimiento de la normativa. El éxito de esto depende en gran medida de dos cosas:
- La brecha entre la necesidad del mercado objetivo y lo que el desarrollador de dispositivos médicos percibe como necesidad; cuanto menor sea la brecha, mejores serán los insumos para la definición del producto;
- Una definición sólida del producto se extrae del análisis de las necesidades del mercado.
El proceso global de desarrollo de dispositivos médicos puede simplificarse según la figura 1 que se muestra a continuación.
Como empresa emergente de productos sanitarios, es importante respaldar su innovación científica y de ingeniería con agilidad para moverse más rápidamente de forma horizontal a través del proceso de decisión reglamentaria, y esto podría lograrse teniendo puntos de control estratégicos en cada etapa del proceso de desarrollo de productos sanitarios. Piense en esto desde el punto de vista del ciclo de vida del producto, se enfrentará a retos en todo momento, desde el inicio de la idea hasta el lanzamiento al mercado y desde la aprobación reglamentaria hasta la adopción por parte del mercado. La cuestión es que los retos y el desarrollo de productos sanitarios van unidos y la única manera de desenredarlos es mediante el impulso científico/ingeniería en el lado del desarrollo y mediante la toma de decisiones reglamentarias basadas en la ciencia en el lado de la aprobación.
2. Clasificación de los dispositivos
Después de idear el producto y definir sus características, el siguiente paso es verificar la clasificación reglamentaria basada en el riesgo de su dispositivo. Debe asegurarse de identificar el riesgo asociado a su dispositivo y seleccionar la clase adecuada en función del mercado reglamentario en el que decida entrar. En esta fase también debe asegurarse de que el uso previsto de su dispositivo está claramente definido. Esto es muy importante y si está planeando el 510(k), asegúrese de que el uso previsto de su dispositivo coincide con el dispositivo predicado.
Dependiendo de la ubicación geográfica y reglamentaria en la que pretenda aplicar su dispositivo médico, ya sea en los Estados Unidos o en la Comisión Europea, puede que tenga que clasificar su dispositivo según el panel de clasificación de dispositivos médicos (Clasificación de dispositivos médicos de la FDA de EE.UU.) o MEDDEV 2.4/1 Rev. 9 (ES orientación MEDDEV), respectivamente. La sección de clasificación de productos sanitarios es, con mucho, el componente más importante de su presentación. Esta sección define los requisitos reglamentarios para su dispositivo. Dependiendo de la clase de dispositivo médico que haya seleccionado, es una buena idea comprobar los documentos de orientación existentes publicados por las autoridades reguladoras. Por ejemplo, en los Estados Unidos, la mitad de las veces es posible que la FDA tenga ya un documento de orientación pertinente para su solicitud. Dichas orientaciones pueden servir de referencia para el ciclo de revisión acelerado y para mejorar las posibilidades de aprobación en su primera presentación. Estos documentos de orientación se publican para guiar tanto a las empresas innovadoras de productos sanitarios como la suya como a los revisores de la agencia para una revisión más rápida de las presentaciones. Además, debe buscar cualquier tipo de propiedad intelectual preexistente sobre la idea propuesta o similar, ya que podría no permitirle utilizar el mecanismo o la tecnología. Para llevar a cabo una fase de descubrimiento completa, es crucial contar con un sólido equipo de desarrollo. Esto puede ser un escollo si el equipo no tiene mucha experiencia. En cualquier caso, puede optar por un equipo interno, un consultor o una empresa de ingeniería de dispositivos médicos.
La consideración clave para las empresas cuando buscan un consultor interno o externo consultor de dispositivos médicos es que deben tener experiencia en las siguientes áreas:
- Ingeniería y diseño
- Factores humanos e ingeniería de usabilidad
- Conocimiento clínico y científico de la industria médica
- Regulatory affairs and quality assurance
- Derecho de la propiedad intelectual
3. Fase de descubrimiento
The discovery phase where you will take your idea into the initial designing stage and develop prototypes for your device. This stage involves a lot of brainstorming with engineers, design consultants and your team to make 3D prototypes through simulations and computer-assisted designs and test those prototypes for proof-of-concept. You should also start looking at the FDA guidance documents to find out which critical functionality tests are pertinent to your device and start using them as a decision-matrix for finalizing the ideal design of your device. For the startups which are still boot-strapping for finances, it will be cost-prohibitive to run all the tests as per the guidance documents so I would rather advise to choose one or two most relevant tests and use them for design optimization. Once you have optimized your medical device concept and design, you may now proceed for regulatory approval and commercialization. It is noteworthy here that the US FDA critical path initiative focused on the science of development: better toxicology, biomarcadores, improved ensayos clínicosy la medicina personalizada, pero esa iniciativa, al igual que otras, incluidas las iniciativas de reingeniería de la década de 1990 y los cambios legislativos que acompañaron a las tasas de uso de los dispositivos, no examinó la estructura reglamentaria del proceso de aprobación en sí y cómo la estructura reglamentaria determina las opciones en la ciencia del desarrollo.
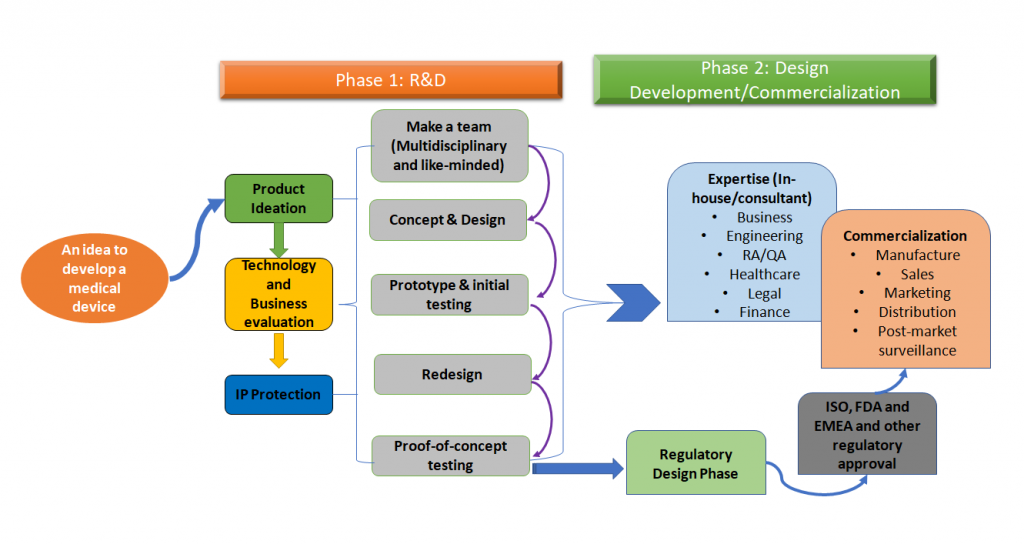
Figura 1: El desarrollo de productos sanitarios es un proceso holístico. Esta es una versión simplificada del proceso, que es un enfoque por fases, pero idealmente, todos los pasos de este proceso completo deben ser trazados desde el principio durante el desarrollo del dispositivo médico (Adaptado de [1,2]).
¿Necesita ayuda para desarrollar un dispositivo médico? Visite consultores de dispositivos médicos en Kolabtree. Es gratis contactar con un experto o publicar tu proyecto.
Lea también: ¿Cuánto cuesta contratar a un consultor de dispositivos médicos?
Referencias
- https://www.welldoc.com/health-plans/
- https://ec.europa.eu/docsroom/documents/10337/attachments/1/translations
- FDA, 2005, Total Product Lifecycle, FDA-CDRH Presentation by CDRH Director Dr. David Feigal, http://www.fda.gov/cdrh/strategic/presentations/ tplc.html
Todos los artículos de esta serie:
Desarrollo y diseño de dispositivos médicos: Una guía definitiva
Desarrollo de dispositivos médicos: 3 consejos para el éxito
Diseño de dispositivos médicos: La guía esencial, paso a paso
Comercialización de dispositivos médicos: 9 pasos desde el boceto hasta el lanzamiento
Cómo superar los retos de la comercialización de dispositivos médicos
Lanzamiento de dispositivos médicos: Pasos clave para llevar su producto al mercado
Vigilancia postcomercialización de dispositivos médicos: Una guía completa







