A Bericht über die klinische Bewertung (CER) is a technical document required by Medizinprodukt companies that want to sell or distribute products in Europe. The CER provides a comprehensive overview of the Medizinprodukt design and composition, intended usage and applications, klinische Studien Analyse und Ergebnisse, einschlägige Literaturberichte, Protokolle und Gebrauchsanweisungen.
EU MDR und CE-Kennzeichnung
Medical devices in Europe need to get a “CE Mark”, which indicates that the product complies with the EU regulations (MDD, MDR or IVDR, whichever is applicable). The recent Medical Device Regulations in Europe has significantly impacted the way medical devices are regulated and approved in the EU. The MDR is the biggest change to medical device legislation in over 20 years. Some major changes in the MDR (as compared with the MDD) include device classification, technical file documentation, traceability and post-market surveillance.
Lesen Sie mehr: Die besten Tipps für die Erlangung des CE-Zeichens für Ihr Medizinprodukt
Bericht über die klinische Bewertung
The MDR places great emphasis on Clinical Evaluation Reports or CERs. The CER forms part of the Technical File, which is the main documentation which demonstrates Einhaltung von Rechtsvorschriften and provides all the information about the device. Medical device companies need to take several measures to make sure that their CER is well-prepared and well-maintained. CER documentation typically comprises 4 stages:
- Festlegung des Anwendungsbereichs des Produkts, seiner Zweckbestimmung und der therapeutischen/diagnostischen Ansprüche
- Identifizierung und Validierung klinischer Daten
- Analyse und Interpretation der Daten, um festzustellen, ob sie alle Anforderungen erfüllen
- Identifizierung von Risiken und Ungewissheiten, die während der Überwachung nach dem Inverkehrbringen (PMS) beantwortet werden können
Eine CER muss während des gesamten Lebenszyklus eines Medizinprodukts regelmäßig aktualisiert werden. Das Dokument sollte den klinischen Nachweis enthalten, der den Nachweis der Konformität mit den Grundlegenden Anforderungen (ER) in MEDDEV 2.7/1 Rev. 4 Anhang 1 (Sicherheits- und Leistungsanforderungen in der MDR) unterstützt. Das Dokument sollte auch die physikalischen und technischen Aspekte und die Zusammensetzung des Produkts sowie die Gebrauchsanweisung beschreiben.
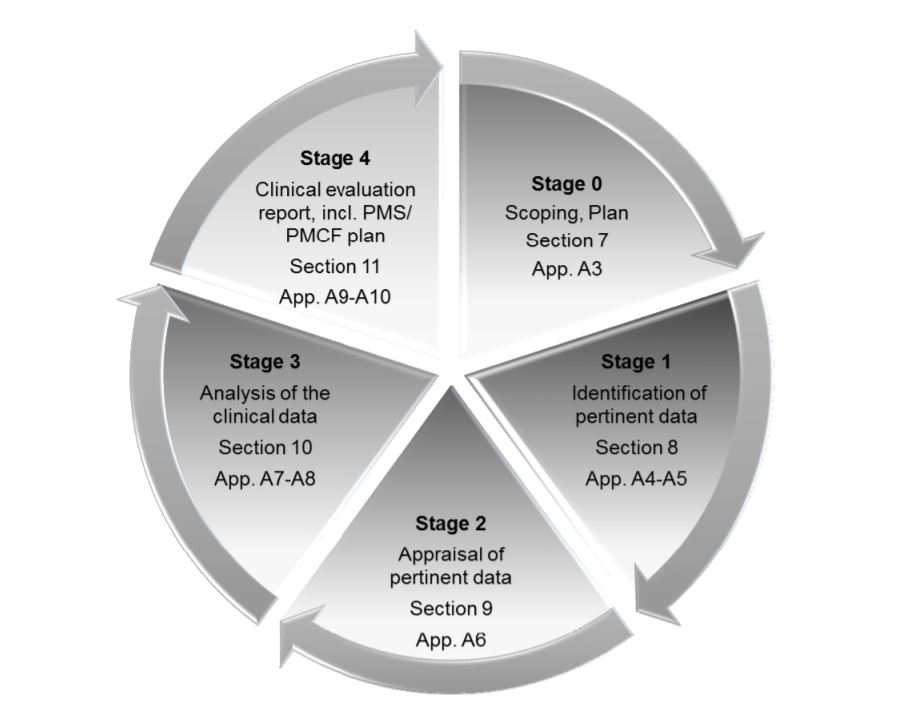
Die vier Phasen der CER, wie sie in MEDDEV 2.7/ rev. 4.
Äquivalenz
Die Hersteller von Medizinprodukten müssen die klinischen Daten ihres eigenen Medizinprodukts oder eines gleichwertigen Produkts bewerten, dessen Sicherheit und klinische Leistung nicht anders ist. Nach der MDR muss der Medizinproduktehersteller drei Faktoren berücksichtigen, um die Gleichwertigkeit eines Produkts nachzuweisen: biologische, technische und klinische Aspekte.
Technische Gleichwertigkeit bedeutet, dass das Gerät dieselben Konstruktionsspezifikationen und dieselbe Zusammensetzung haben muss und unter denselben Bedingungen, mit derselben Einsatzmethode und denselben Betriebsprinzipien verwendet werden muss. Klinische Gleichwertigkeit bedeutet, dass das Produkt zur Behandlung desselben Leidens, an derselben Stelle des Körpers und für dieselbe Bevölkerungsgruppe verwendet werden muss, wobei eine ähnliche Leistung erzielt werden muss.
Biologische Gleichwertigkeit bedeutet, dass das betreffende Medizinprodukt kein biologisches Risiko verursachen darf.
Wenn ein Medizinprodukt die Gleichwertigkeit nicht nachweisen kann, muss es entweder weitere klinische Untersuchungen durchführen oder die Angabe von seinem Produkt entfernen.
Literaturübersicht
Die Ergebnisse der Literaturrecherche sind ein zentraler Bestandteil des Berichts über die klinische Bewertung: Es muss ein solides Verfahren für die Literaturrecherche eingerichtet werden, damit die gesamte veröffentlichte Literatur, die für das Produkt relevant ist, leicht zugänglich ist und die Behauptung untermauern kann, die aufgestellt wird. Für die Literaturrecherche ist in der Regel das Fachwissen eines erfahrenen Forschers erforderlich, der den richtigen Suchbegriff ermitteln, Datenbanken wie PubMED oder MEDLine nutzen, relevante Literatur finden und diese bewerten kann, einschließlich der Verwendung relevanter Referenzen. Die Literaturübersicht sollte auch auf Fragen eingehen, die die klinischen Daten nicht beantworten können.
Wie lange dauert es, eine CER zu schreiben?
Die Ermittlung und Erfassung aller Daten, die in die CER einfließen, und die Erstellung des Dokuments gemäß den Leitlinien kann mehrere Wochen oder Monate dauern. Die Überwachung nach dem Inverkehrbringen (Post-Market Surveillance, PMS) ist ein wichtiger Bestandteil des Prozesses, auch nach der CE-Zertifizierung, und PMS muss ein zentraler Bestandteil des Qualitätsmanagementsystems (QMS) des Herstellers sein. In einigen Fällen ist auch eine klinische Nachbeobachtung nach dem Inverkehrbringen (Post-Market Clinical Followup, PMCF) erforderlich, bei der proaktiv klinische Daten gesammelt und zur Erfüllung der Sicherheits- und Leistungsanforderungen ausgewertet werden.
Die CER ist kein statisches Dokument. Es wird empfohlen, dass die Hersteller von Medizinprodukten einen robusten Prozess und eine Strategie mit bewährten Verfahren entwickeln, um den Marktzugang in der EU zu erhalten, Produktrückrufe zu vermeiden und den Zeit- und Ressourcenaufwand für die Pflege des Dokuments zu verringern.
Die Auslagerung des CER-Schreibens an einen freiberuflichen Experten kann helfen, wertvolle Zeit und Energie zu sparen. Freiberufliche Verfasser von Berichten über klinische Bewertungen können auf Kolabtree CERs ab 3.000 USD entwickeln.
Verfasser von Berichten zur klinischen Bewertung
The time and expertise required to put together a CER can be a resource strain for several medical device startups or medical device SMBs, who may not have in-house specialists. Working with external experts, including freelance CER writers, clinical data analysts, literature review experts biostatisticians and medizinische Redakteure can help companies make sure that their CER strategy is robust and their data is all verified and accurate.
Wie man einen freiberuflichen CER-Autor einstellt
Zu den Fähigkeiten, die ein CER-Autor mitbringen sollte, gehören Erfahrung im Umgang mit Vorschriften für Medizinprodukte und Zulassungsverfahren, Vertrautheit mit MEDDEV 2.7/ rev. 4, Kenntnisse über therapeutische Bereiche und starke analytische Fähigkeiten. Der globale Expertenpool von Kolabtree umfasst qualifizierte Verfasser von klinischen Bewertungsberichtendie Ihnen helfen können, eine gut recherchierte und gründliche CER zusammenzustellen. Es ist kostenlos, Ihr Projekt einzustellen und Angebote von Experten einzuholen. Los geht's
Verwandte Experten:
Berater für medizinische Geräte | Freiberufliche medizinische Autorin | Freiberufliche CER-Autorin | EU-MDR-Berater | FDA-Einreichungen | Experten für Literatursuche | Experten für die Einhaltung gesetzlicher Vorschriften | Experte für klinische Studien | Regulatory Writers | PMS-Berater | PMCF-Berater | Biostatistik-Experten | Experte für Produktentwicklung







