Kolabtree freelance biostatistician consultant, Rudra Patel provides a comprehensive guide on how to develop a Statistical Analysis Plan (SAP) for Klinische Studien.
1. Statistischer Analyseplan (SAP) in einer klinischen Prüfung (CT)
Ein gut ausgearbeiteter und vollständiger statistischer Analyseplan (SAP) ist wichtig, um die Qualität der klinischen Prüfungen und die Gültigkeit und Verallgemeinerbarkeit zu erhöhen.
SAP is a defined outline of the planned statistical basic/advance methods for the analyses for a clinical trial and is written in study protocol as well as separately. SAP is crucial and is one of the key Regulatory confidential documents in the development of a clinical trial. An SAP is a more challenging task in a clinical trial protocol development that requires a strong command on statistical methodology, medical terminology and visualization power. It provides explicit guidance on statistical programming and the presentation of results for clinical trial. The following four important types of SAP are used in a clinical trial (Figure 1).
- Überwachung der Daten
- Statistische Zwischenanalyse
- Integrierter statistischer Analyseplan
- Statistischer Analyseplan für die klinische Studie
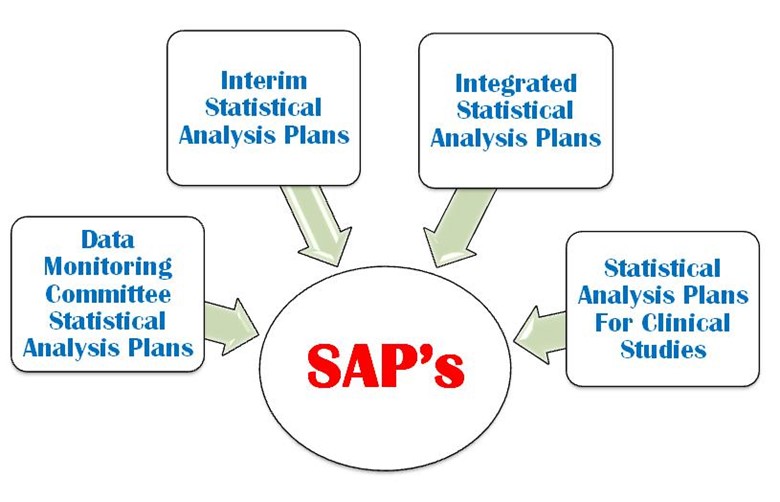
Abbildung 1: Vier wichtige Arten von SAP werden in einer CT verwendet
The SAP is mostly written as a separate document or it is included in CT study protocol as a standard operating procedure for dealing with the statistical part of the clinical study. A team medizinischer Statistiker/biostatistician is in-charge of developing the SAP in coordination with the principal investigator of the CT study. The document should be reviewed by Senior Biostatistician and finalized before to submission to the review board and regulatory authorities. If any protocol amendments are done, then the SAP is amended as well.
The SAP must properly explain following the aims and primary objectives, secondary objective, exploratory objectives, primary/secondary/exploratory endpoints, trial population, design of the trial, sample size calculations with justifications/assumptions, and the randomization methods. Additionally, an SAP must describe in detail the statistical methodology i.e. efficacy analysis, safety Datenanalyse, reporting conventions, etc. Figure 2 shows the most important points that need to be considering when developing SAP in the clinical trial study protocol.
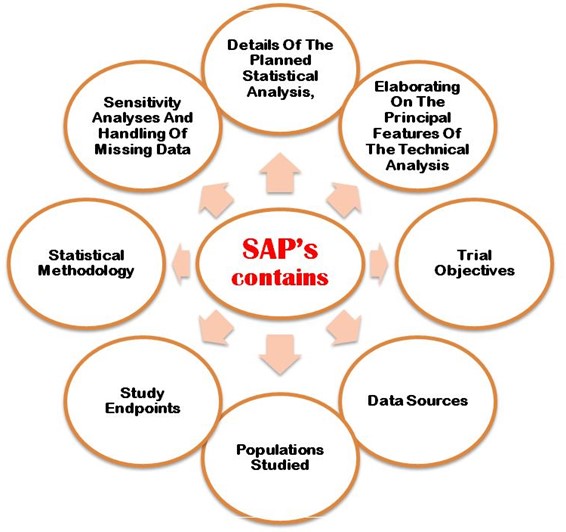
Abbildung 2: Detaillierte wichtige Punkte, die bei der Entwicklung von SAP im CT-Protokoll zu berücksichtigen sind.
Der entwickelte Analyseplan sollte von einem leitenden verblindeten Biostatistiker besonders sorgfältig geprüft und genehmigt werden, bevor die Datenbank von den Behörden gesperrt wird. Ahrweiler et al. 2011 In einem online veröffentlichten Konferenzbeitrag wurde die Bedeutung der Überprüfung des statistischen Analyseplans erläutert. Im Folgenden werden wichtige Punkte aufgeführt, die bei der Entwicklung von SAP im CT-Protokoll zu berücksichtigen sind,
- Detaillierte Angaben zur geplanten statistischen Analyse
- Ausarbeitung der wichtigsten Merkmale der technischen Analyse.
- Ziele der Studie
- Datenquellen
- Untersuchte Bevölkerung
- Endpunkte der Studie
- Statistische Methodik
- Sensitivitätsanalyse und fehlende Daten
Das SAP für die klinische Prüfung sollte in einer eingehenden Diskussion zwischen den Hauptprüfern und dem Statistiker entwickelt werden. Im Folgenden werden die Rolle und die Verantwortung des Statistikers beschrieben,
- Zum Schreiben einer Forschung statement or hypothesis of the clinical trial study.
- Bestimmen Sie die primären Endpunkte und die sekundären Endpunkte.
- Herausfinden und Entwickeln einer Strategie zur Verringerung von Verzerrungen und zur Auswahl der Stichprobengröße für klinische Studien
- Festlegung aller geeigneten statistischen Methoden für die Datenanalyse klinischer Prüfungen
Bei der Entwicklung von SAP in der klinischen Prüfung müssen die wichtigsten Punkte eingehend erläutert werden. Yuan et al.2019 veröffentlichte einen Fachartikel über "Leitfaden für den statistischen Analyseplan" [Abbildung 2]. Der Artikel enthält eine ausführliche Darstellung des SAP einer aktuellen klinischen Studie, um einen detaillierten praktischen Leitfaden für die Erstellung eines wirksamen SAP zu bieten. Darüber hinaus wird in demselben Papier erörtert, wo, was und warum ein SAP erstellt wird, wann und von wem, und es werden die wichtigsten Inhalte des SAPs hervorgehoben. Die Notwendigkeit von gut geschriebenen und dokumentierten SAPs für klinische Studien, insbesondere für regulatorische Studien.
2. Die Bedeutung des statistischen Analyseplans in klinischen Prüfungen
CT wird bei allen neuen Verfahren zur Entwicklung von Arzneimitteln und Medizinprodukten durchgeführt. In den letzten zehn Jahren wurden immer mehr Patienten aus Europa und den USA sowie aus Entwicklungsländern für klinische Studien zur Entwicklung von Arzneimitteln rekrutiert.
Bei klinischen Studien ist der SAP eines der wichtigsten Dokumente. Es stellt sicher, dass die Analysen zur Bewertung aller vorab geplanten Studienhypothesen auf wissenschaftlich gültige Weise durchgeführt und alle Entscheidungen dokumentiert werden. Außerdem wird darin ausführlich beschrieben, wie die Ergebnisse in der CT dargestellt und berichtet werden.
Klinische Studien dienen der Bewertung des Zusatznutzens und der Verbesserung von Maßnahmen in der Medizin Gesundheitsfürsorge. The more important thing to consider while conducting a clinical trial is to execute the trial with minimum bias. Therefore, each clinical trial to have a clear and detailed SAP to its support to reproducibility. For the best practice of CT scientific research studies, reproducibility of research, and to avoid concerns of misuse of clinical research, a clear detailed and very transparent SAP much be needed, to improve trial conduct and reporting. Following are three essential roles of SAP needs to maintain in conducting CT.
- Transparenz: Transparenz in Bezug auf das Vorgehen bei der Analyse, indem die angewandte Methodik im Voraus festgelegt wird
- Kommunikation: Klare Kommunikation mit allen an der Studie Beteiligten über das weitere Vorgehen
- Replikation: Erleichtert die Replikation, so dass ein künftiges Forschungsteam die gleichen Schritte durchführen kann, um die Ergebnisse an derselben oder einer neuen Probe zu bestätigen.
Gemäß den Standardrichtlinien und bewährten Verfahren ist es wichtig, dass der Projektstatistiker/Biostatistiker für die klinische Prüfung vor Beginn der klinischen Prüfung ein Studien-SAP erstellt, in dem alle geplanten Analysen, Studienparameter, einschließlich der Definitionen der Analysesätze und der grundlegenden/fortgeschrittenen statistischen Methodik aufgeführt sind.
Darüber hinaus gibt es weitere wichtige Überlegungen zu SAP in der CT:
- Eine Möglichkeit zur Minimierung von Verzerrungen besteht darin, den Biostatistiker zu blenden.
- Das SAP sollte so dokumentiert werden, dass alle durchgeführten Datenmanipulationen und Analysen nachvollzogen werden können.
- Der Biostatistiker muss nach Abschluss der Prüfung eine Stammdatei mit allen relevanten Unterlagen führen.
Der systematisch aufgebaute Analyseplan hilft dem Team der klinischen Prüfung, gemeinsam an einem Strang zu ziehen, und verleiht dem CT eine weitere Ebene der Spezifität. Er beschreibt die systematisch geplante statistische Methodik einer Forschungsstudie im Rahmen einer klinischen Prüfung. Im Vergleich zum Protokoll einer klinischen Prüfung ist der SAP ein detailliertes technisches Dokument, in dem ausführliche statistische Techniken für das Studiendesign und die Analyse der Daten klinischer Prüfungen beschrieben werden. Bei der Erstellung von SAP halten wir uns im Allgemeinen an die ICH-Richtlinien E3 und E9. Dies gibt uns eine Vorstellung vom Inhalt der einzelnen Abschnitte des SAP. In E3 und E9 werden jedoch keine spezifischen statistischen Verfahren beschrieben.
Verbesserung der Reproduzierbarkeit, Transparenz und Validität von klinischen Studien. Nationale Gesundheitsinstitute (NIH) veröffentlichte "Rules for clinical trials studies registration and results information submission" (Regeln für die Registrierung von klinischen Studien und die Übermittlung von Informationen über die Ergebnisse), in denen die Registrierung der Studie, die Veröffentlichung der laufenden Rekrutierung oder der Ergebnisse der klinischen Studie auf ClinicalTrials.gov und die Übermittlung des separaten Originaldokuments "Statistical analysis plan" (SAP) zusammen mit dem Studienprotokoll der klinischen Studie vorgeschrieben sind.
Der große Beitrag des Medizinstatistikers/Biostatistikers besteht neben der Entwicklung eines Standard-SAP in der Gestaltung, Überwachung und Analyse von Daten aus klinischen Studien.
3. Detaillierte Checkliste/Leitlinien für SAPs in klinischen Prüfungen
Bei der Entwicklung von SAP für CT müssen wir alle detaillierten Checklisten/Standardrichtlinien berücksichtigen. Wichtige Leitlinien für die Entwicklung von SAP sind ICH E9 (International Conference for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use) und SPIRIT (Standard Protocol Items: Recommendations for Interventional Trials).
Transparenz und Reproduzierbarkeit sind ein grundlegender Begriff, der den Wert von Daten aus klinischen Studien erhöht. Der Einfluss der statistischen Methodik wirkt sich jedoch direkt auf die Entscheidungsfindung bei klinischen Prüfungen aus. Eine gut dokumentierte, vertrauliche und transparente statistische Vorgehensweise ist daher unerlässlich. Erfahrene medizinische Statistiker/Biostatistiker können bei der Entwicklung von SAPs in Übereinstimmung mit den Standardrichtlinien helfen.
Gemäß ICH E9 werden SAP in der Regel als Berichts- und Analysepläne bezeichnet. In anderen Organisationen werden sie auch als Datenanalysepläne (DAP) oder statistische Analysepläne (SAP) bezeichnet. In den ICH E9-Leitlinien heißt es, dass "die Hauptmerkmale der eventuellen SAP der Daten im statistischen Teil des Protokolls beschrieben werden sollten". Die SPIRIT-Leitlinien (Standard Protocol Items: Recommendations for Interventional Trials) verweisen jedoch auf einen separaten SAP.
Der SAP ist ein wesentliches Dokument in der CT, das den Aufsichtsbehörden (z. B. Food and Drug Administration (FDA), die Europäische Arzneimittel-Agentur (EMA)). In den Standardrichtlinien wird empfohlen, SAP in der vertraulichen Stammdatei der klinischen Prüfung zu speichern, und es wird bei Audits der Aufsichtsbehörden verwendet, um zu prüfen, ob die statistischen Dokumente genau den Standardrichtlinien entsprechen.
Der SAP ist das am häufigsten verwendete Dokument zur Anleitung der Statistiker. Im Allgemeinen sollte ein SAP die folgenden Punkte enthalten (Abbildung 3).
Der Statistiker sollte auf folgende Stellen verwiesen werden Die CONSORT-Erklärung (und alle Erweiterungen) und auch ICH E9 Statistische Grundsätze für klinische Prüfungen (PDF, 325 KB).
- Versuchsplanung & Designstation
- Das EQUATOR-Netzwerk- Ein Ressourcenzentrum für gute Berichterstattung über Gesundheitsforschungsstudien.
- Die CONSORT-Website
- Die 2017 veröffentlichten Leitlinien von Gamble und andere.2017 empfehlen die Leitlinien dieser Artikel ein Minimum von 55 wichtigen Punkten, die bei der Entwicklung eines SAP-Folges berücksichtigt werden sollten.
- Titel und Registrierung
- Einführung
- Methoden der Studie
- Statistische Grundsätze
- Bevölkerung der Studie
- Analyse
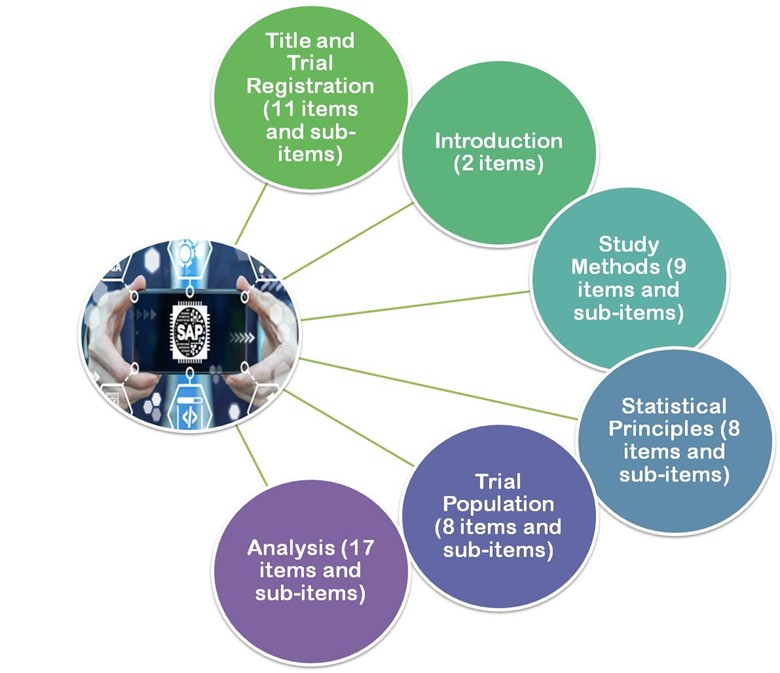
Abbildung 3: Gamble und andere. 2017 sind die Leitlinien in 6 große Abschnitte unterteilt.
4. Woraus besteht ein SAP?
A Checkliste von 32 detaillierten Checklisten für die Entwicklung der Checkliste für den statistischen Analyseplan (SAP) (Word). Sie sollen in erster Linie für die endgültigen Analysen von CTs sowie für spätere randomisierte CTs anwendbar sein. Die wichtigsten von der FDA entwickelten Leitlinien Leitfaden für die Industrie: Statistische Grundsätze für klinische Prüfungen.
Die folgenden Leitlinien und Empfehlungen für den Inhalt eines SAP:
- SAP ist kein eigenständiges Dokument und sollte in Verbindung mit dem klinischen Prüfplan gelesen werden.
- Der klinische Prüfplan sollte mit den Grundsätzen der SPIRIT 2013 Erklärung.
- Das SAP ist auf einen sauberen oder validierten Datensatz zur Analyse anzuwenden.
Detaillierte Leitlinien, die von Geldgebern, Regulierungsbehörden, Fachzeitschriften, Industrievertretern und UK Clinical Research Collaboration registrierte klinische Versuchseinheiten (UKCRC CTUs). Die Guidelines for the Content of Statistical Analysis Plans in Clinical Trials beschreiben ausführlich JAMA. Eine detailliertere Erläuterung der einzelnen Punkte der Checkliste finden Sie jedoch in der Ausarbeitungsdokument. Die ebenfalls enthaltene SAP-Anweisung ist in der Äquator-Netzwerk und MRC-NIHR Forschungspartnerschaft für Versuchsmethodik (TMRP). Im Folgenden sind die wichtigsten Dokumente und Links aufgeführt, die bei der Entwicklung von SAP in klinischen Prüfungen verwendet werden (Abbildung 4).
- Schlüsseldokument
- Checkliste
- Ausarbeitung
- JAMA-Aufsatz
- Wichtige Links
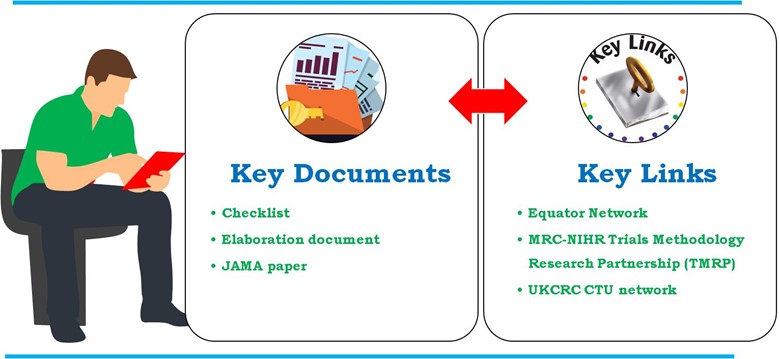
Abbildung 4: Wichtige Dokumente und Links, die bei der Entwicklung von SAP in der klinischen Prüfung verwendet werden
5. Beauftragung eines freiberuflichen klinischen Statistikers zur Unterstützung bei SAPs
Die Entwicklung eines SAP erfordert häufig die Unterstützung durch einen freiberuflichen klinischen Statistiker. Mit der Hilfe eines erfahrenen Biostatistikers können Sie ein gründliches und fehlerfreies SAP entwickeln, das die Qualität Ihrer klinischen Studien verbessert.
Durchsuchen Sie Berater für klinische Studien auf Kolabtree und setzen Sie sich direkt mit einem Experten in Verbindung.







